Peran Multi-Dimensi Badan Keton
Badan keton dibuat oleh hati dan digunakan sebagai sumber energi ketika glukosa tidak tersedia di tubuh manusia. Dua badan keton utama adalah asetoasetat (AcAc) dan 3-beta-hidroksibutirat (3HB), sedangkan aseton adalah badan keton ketiga dan paling sedikit. Keton selalu ada dalam darah dan kadarnya meningkat selama puasa dan olahraga yang berkepanjanganKetogenesis adalah proses biokimia dimana organisme menghasilkan tubuh keton melalui pemecahan asam lemak dan asam amino ketogenik.
Badan keton terutama dihasilkan dalam mitokondria sel hati. Ketogenesis terjadi ketika ada kadar glukosa yang rendah dalam darah, terutama setelah penyimpanan karbohidrat seluler lainnya, seperti glikogen, telah habis. Mekanisme ini juga dapat terjadi ketika jumlah insulin tidak mencukupi. Produksi badan keton pada akhirnya dimulai untuk membuat energi yang tersedia yang disimpan dalam tubuh manusia sebagai asam lemak. Ketogenesis terjadi di mitokondria di mana ia secara independen diatur.
Abstrak
Metabolisme tubuh keton merupakan simpul sentral dalam homeostasis fisiologis. Dalam ulasan ini, kami membahas bagaimana keton melayani peran metabolik fine-tuning yang mengoptimalkan kinerja organ dan organisme dalam berbagai sisa nutrisi dan melindungi dari peradangan dan cedera pada berbagai sistem organ. Secara tradisional dipandang sebagai substrat metabolik terdaftar hanya dalam pembatasan karbohidrat, observasi terbaru menggarisbawahi pentingnya tubuh keton sebagai mediator metabolik dan sinyal vital ketika karbohidrat berlimpah. Melengkapi repertoar pilihan terapi yang dikenal untuk penyakit pada sistem saraf, peran prospektif untuk tubuh keton pada kanker telah muncul, seperti memiliki peran protektif yang menarik di jantung dan hati, membuka opsi terapeutik pada penyakit terkait obesitas dan kardiovaskular. Kontroversi dalam metabolisme keton dan sinyal dibahas untuk mendamaikan dogma klasik dengan pengamatan kontemporer.
Pengantar
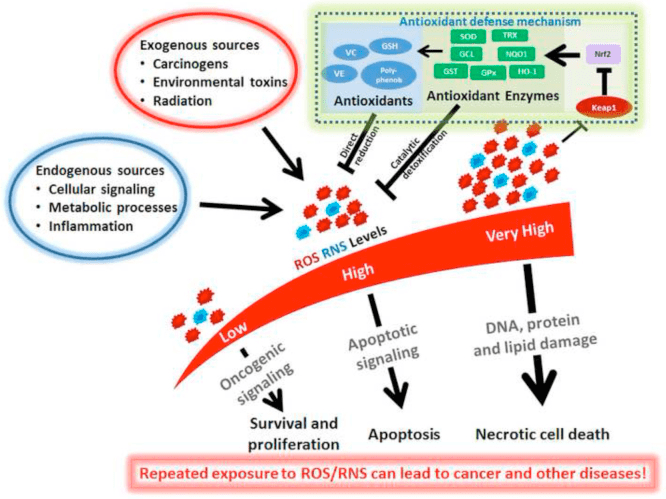
Badan keton merupakan sumber bahan bakar metabolik alternatif yang vital untuk semua domain kehidupan, eukarya, bakteri, dan archaea (Aneja et al., 2002; Cahill GF Jr, 2006; Krishnakumar et al., 2008). Metabolisme tubuh keton pada manusia telah dimanfaatkan untuk bahan bakar otak selama periode kekurangan nutrisi episodik. Badan keton terjalin dengan jalur metabolisme mamalia penting seperti? -Oksidasi (FAO), siklus asam trikarboksilat (TCA), glukoneogenesis, lipogenesis de novo (DNL), dan biosintesis sterol. Pada mamalia, badan keton diproduksi terutama di hati dari asetil-KoA yang diturunkan dari FAO, dan diangkut ke jaringan ekstrahepatik untuk oksidasi terminal. Fisiologi ini menyediakan bahan bakar alternatif yang ditambah dengan periode puasa yang relatif singkat, yang meningkatkan ketersediaan asam lemak dan mengurangi ketersediaan karbohidrat (Cahill GF Jr, 2006; McGarry dan Foster, 1980; Robinson dan Williamson, 1980). Oksidasi tubuh keton menjadi kontributor yang signifikan untuk metabolisme mamalia energi secara keseluruhan dalam jaringan ekstrahepatik dalam berbagai keadaan fisiologis, termasuk puasa, kelaparan, periode neonatal, pasca-olahraga, kehamilan, dan kepatuhan terhadap diet rendah karbohidrat. Konsentrasi tubuh keton total yang bersirkulasi pada manusia dewasa yang sehat biasanya menunjukkan osilasi sirkadian antara sekitar 100 250 M, meningkat menjadi ~ 1 mM setelah latihan yang lama atau 24 jam puasa, dan dapat terakumulasi hingga setinggi 20 mM dalam keadaan patologis seperti ketoasidosis diabetikum ( Cahill GF Jr, 2006; Johnson et al., 1969b; Koeslag et al., 1980; Robinson dan Williamson, 1980; Wildenhoff et al., 1974). Hati manusia menghasilkan hingga 300 g badan keton per hari (Balasse dan Fery, 1989), yang menyumbang antara 5 20% dari total pengeluaran energi dalam keadaan makan, berpuasa, dan kelaparan (Balasse et al., 1978; Cox et al. al., 2016).
Studi terbaru sekarang menyoroti peran penting untuk badan keton dalam metabolisme sel mamalia, homeostasis, dan memberi sinyal di bawah berbagai keadaan fisiologis dan patologis. Selain berfungsi sebagai bahan bakar energi untuk jaringan ekstrahepatik seperti otak, jantung, atau otot rangka, tubuh keton memainkan peran penting sebagai mediator sinyal, driver protein pasca-translasi modifikasi (PTM), dan modulator peradangan dan stres oksidatif. Dalam ulasan ini, kami memberikan pandangan klasik dan modern dari peran pleiotropik tubuh keton dan metabolisme mereka.
Ikhtisar Metabolisme Tubuh Keton
Laju ketogenesis hati diatur oleh serangkaian transformasi fisiologis dan biokimia lemak yang diatur. Regulator utama termasuk lipolisis asam lemak dari triasilgliserol, transportasi ke dan melintasi membran plasma hepatosit, transportasi ke mitokondria melalui karnitin palmitoyltransferase 1 (CPT1), spiral oksidasi?, Aktivitas siklus TCA dan konsentrasi menengah, potensi redoks, dan regulator hormonal. proses ini, terutama glukagon dan insulin [ditinjau dalam (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; McGarry dan Foster , 1980; Williamson et al., 1969)]. Ketogenesis klasik dipandang sebagai jalur limpahan, di mana? -Oksidasi yang diturunkan asetil-KoA melebihi aktivitas sintase sitrat dan / atau ketersediaan oksaloasetat untuk kondensasi membentuk sitrat. Bahan antara tiga karbon menunjukkan aktivitas anti-ketogenik, mungkin karena kemampuannya untuk memperluas kolam oksaloasetat untuk konsumsi asetil-KoA, tetapi konsentrasi asetil-KoA hati saja tidak menentukan tingkat ketogenik (Foster, 1967; Rawat dan Menahan, 1975; Williamson dkk., 1969). Regulasi ketogenesis oleh peristiwa hormonal, transkripsi, dan pasca-translasi bersama-sama mendukung gagasan bahwa mekanisme molekuler yang menyempurnakan tingkat ketogenik masih belum sepenuhnya dipahami (lihat Regulasi HMGCS2 dan SCOT / OXCT1).
Ketogenesis terjadi terutama pada matriks mitokondria hati dengan kecepatan yang sebanding dengan oksidasi lemak total. Setelah pengangkutan rantai asil melintasi membran mitokondria dan? -Oksidasi, isoform mitokondria dari 3-hidroksimetilglutaril-KoA sintase (HMGCS2) mengkatalisis nasib yang melakukan kondensasi asetoasetil-KoA (AcAc-CoA) dan asetil-KoA untuk menghasilkan HMG-KoA (Gambar 1A). HMG-CoA lyase (HMGCL) membelah HMG-CoA untuk membebaskan asetil-KoA dan asetoasetat (AcAc), dan yang terakhir direduksi menjadi d -? - hidroksibutirat (d-? OHB) oleh mitokondria yang bergantung pada fosfatidilkolin d-? OHB dehidrogenase ( BDH1) dalam reaksi NAD + / NADH-digabungkan mendekati kesetimbangan (Bock dan Fleischer, 1975; LEHNINGER et al., 1960). Konstanta kesetimbangan BDH1 mendukung produksi d-? OHB, tetapi rasio badan keton AcAc / d-? OHB berbanding lurus dengan rasio NAD + / NADH mitokondria, dan dengan demikian aktivitas BDH1 oksidoreduktase memodulasi potensial redoks mitokondria (Krebs et al., 1969; Williamson et al., 1967). AcAc juga dapat secara spontan dekarboksilat menjadi aseton (Pedersen, 1929), sumber bau manis pada manusia yang menderita ketoasidosis (yaitu, total serum ketone body> ~ 7 mM; AcAc pKa 3.6,? OHB pKa 4.7). Mekanisme di mana badan keton diangkut melintasi membran dalam mitokondria tidak diketahui, tetapi AcAc / d-? OHB dilepaskan dari sel melalui pengangkut monokarboksilat (pada mamalia, MCT 1 dan 2, juga dikenal sebagai pembawa zat terlarut anggota keluarga 16A 1 dan 7) dan diangkut dalam sirkulasi ke jaringan ekstrahepatik untuk oksidasi terminal (Cotter et al., 2011; Halestrap dan Wilson, 2012; Halestrap, 2012; Hugo et al., 2012). Konsentrasi badan keton yang bersirkulasi lebih tinggi daripada yang ada di jaringan ekstrahepatik (Harrison dan Long, 1940) yang menunjukkan badan keton diangkut ke gradien konsentrasi. Mutasi hilangnya fungsi pada MCT1 dikaitkan dengan serangan ketoasidosis spontan, menunjukkan peran penting dalam impor tubuh keton.
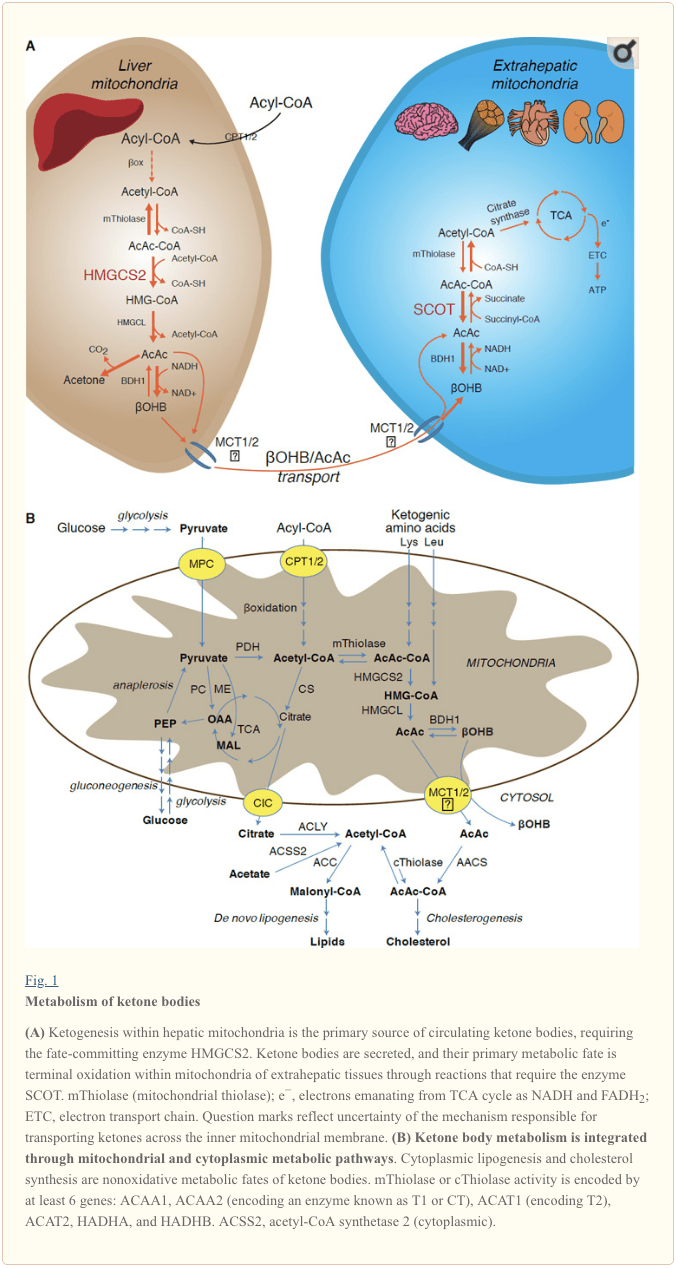
Dengan pengecualian potensi pengalihan badan keton menjadi non-oksidatif (lihat Nasib metabolik non-oksidatif badan keton), hepatosit tidak memiliki kemampuan untuk memetabolisme badan keton yang mereka hasilkan. Badan keton yang disintesis de novo oleh hati (i) dikatabolisme di mitokondria jaringan ekstrahepatik menjadi asetil-KoA, yang tersedia untuk siklus TCA untuk oksidasi terminal (Gbr. 1A), (ii) dialihkan ke jalur lipogenesis atau sintesis sterol ( Gambar 1B), atau (iii) diekskresikan dalam urin. Sebagai bahan bakar energi alternatif, badan keton banyak teroksidasi di jantung, otot rangka, dan otak (Balasse dan Fery, 1989; Bentourkia et al., 2009; Owen et al., 1967; Reichard et al., 1974; Sultan, 1988 ). BDH1 mitokondria ekstrahepatik mengkatalisis reaksi pertama oksidasi ?OHB, mengubahnya menjadi AcAc kembali (LEHNINGER et al., 1960; Sandermann et al., 1986). Sitoplasma d-?OHB-dehydrogenase (BDH2) dengan hanya 20% identitas urutan ke BDH1 memiliki Km tinggi untuk badan keton, dan juga berperan dalam homeostasis besi (Davuluri et al., 2016; Guo et al., 2006) . Dalam matriks mitokondria ekstrahepatik, AcAc diaktifkan menjadi AcAc-CoA melalui pertukaran bagian CoA dari suksinil-KoA dalam reaksi yang dikatalisis oleh transferase CoA mamalia yang unik, suksinil-KoA:3-asam okso-CoA transferase (SCOT, CoA transferase; dikodekan oleh OXCT1), melalui reaksi kesetimbangan dekat. Energi bebas yang dilepaskan oleh hidrolisis AcAc-CoA lebih besar daripada suksinil-CoA, mendukung pembentukan AcAc. Jadi fluks oksidatif badan keton terjadi karena aksi massa: suplai AcAc yang melimpah dan konsumsi cepat asetil-KoA melalui sitrat sintase mendukung pembentukan AcAc-CoA (+ suksinat) oleh SCOT. Khususnya, berbeda dengan glukosa (heksokinase) dan asam lemak (asil-KoA sintetase), aktivasi badan keton (SCOT) menjadi bentuk yang dapat dioksidasi tidak memerlukan investasi ATP. Reaksi tiolase AcAc-CoA reversibel [dikatalisis oleh salah satu dari empat tiolase mitokondria yang dikodekan oleh ACAA2 (pengkodean enzim yang dikenal sebagai T1 atau CT), ACAT1 (pengkodean T2), HADHA, atau HADHB] menghasilkan dua molekul asetil-KoA, yang memasuki siklus TCA (Hersh dan Jencks, 1967; Stern et al., 1956; Williamson et al., 1971). Selama keadaan ketotik (yaitu, keton serum total > 500 M), badan keton menjadi kontributor yang signifikan untuk pengeluaran energi dan digunakan dalam jaringan dengan cepat sampai penyerapan atau saturasi oksidasi terjadi (Balasse et al., 1978; Balasse dan Fery, 1989 ; Edmond dkk., 1987). Fraksi yang sangat kecil dari badan keton yang berasal dari hati dapat dengan mudah diukur dalam urin, dan tingkat pemanfaatan dan reabsorpsi oleh ginjal sebanding dengan konsentrasi sirkulasi (Goldstein, 1987; Robinson dan Williamson, 1980). Selama keadaan sangat ketotik (> 1 mM dalam plasma), ketonuria berfungsi sebagai reporter semi-kuantitatif ketosis, meskipun sebagian besar uji klinis badan keton urin mendeteksi AcAc tetapi tidak ?OHB (Klocker et al., 2013).
Substrat ketogenik dan dampaknya terhadap Metabolisme Hepatosit
Substrat ketogenik termasuk asam lemak dan asam amino (Gambar. 1B). Katabolisme asam amino, terutama leusin, menghasilkan sekitar 4% dari badan keton dalam keadaan pasca-serap (Thomas et al., 1982). Dengan demikian kolam substrat acetyl-CoA untuk menghasilkan badan keton terutama berasal dari asam lemak, karena selama keadaan suplai karbohidrat berkurang, piruvat memasuki siklus TCA hati terutama melalui anaplerosis, yaitu carboxylation ATP-dependent ke oxaloacetate (OAA), atau ke malat (MAL), dan bukan dekarboksilasi oksidatif menjadi asetil-KoA (Jeoung et al., 2012; Magnusson et al., 1991; Merritt et al., 2011). Di hati, glukosa dan piruvat berkontribusi secara tidak berarti terhadap ketogenesis, bahkan ketika piruvat dekarboksilasi ke asetil-KoA adalah maksimal (Jeoung et al., 2012).
Asetil-CoA menyumbangkan beberapa peran yang tidak terpisahkan dengan metabolisme perantara di luar generasi ATP melalui oksidasi terminal (lihat juga Integrasi metabolisme tubuh keton, modifikasi pasca-translasi, dan fisiologi sel). Acetyl-CoA alosterik mengaktifkan (i) piruvat karboksilase (PC), sehingga mengaktifkan mekanisme kontrol metabolik yang menambah masuknya metabolit ke dalam siklus TCA (Owen et al., 2002; Scrutton dan Utter, 1967) dan (ii) dehidrogenase piruvat kinase, yang memfosforilasi dan menghambat dehidrogenase piruvat (PDH) (Cooper et al., 1975), sehingga lebih meningkatkan aliran piruvat ke dalam siklus TCA melalui anaplerosis. Selanjutnya, asetil-CoA sitoplasma, yang kolamnya ditambah dengan mekanisme yang mengubah aseton-CoA mitokondria menjadi metabolit yang dapat diangkut, menghambat oksidasi asam lemak: asetil-KoA karboksilase (ACC) mengkatalisis konversi asetil-KoA menjadi malonyl-CoA, substrat lipogenik dan allosteric inhibitor mitokondria CPT1 [ditinjau dalam (Kahn et al., 2005; McGarry and Foster, 1980)]. Dengan demikian, kolam asetil-CoA mitokondria baik mengatur dan diatur oleh jalur spillover dari ketogenesis, yang mengatur aspek-aspek kunci dari metabolisme perantara hati.
Takdir Metabolis Non-oksidatif dari Badan Keton
Nasib dominan dari keton yang berasal dari hati adalah oksidasi ekstrahepatik SCOT-dependent. Namun, AcAc dapat diekspor dari mitokondria dan digunakan dalam jalur anabolik melalui konversi ke AcAc-CoA oleh reaksi tergantung ATP yang dikatalisis oleh sitoplasmik acetoacetyl-CoA synthetase (AACS, Gambar. 1B). Jalur ini aktif selama perkembangan otak dan kelenjar susu menyusui (Morris, 2005; Robinson dan Williamson, 1978; Ohgami et al., 2003). AACS juga sangat diekspresikan dalam jaringan adiposa, dan osteoklas teraktivasi (Aguilo et al., 2010; Yamasaki et al., 2016). AcAc-CoA sitoplasma dapat diarahkan oleh HMGCS1 sitosol menuju biosintesis sterol, atau dibelah oleh salah satu dari dua thiolase sitoplasma menjadi asetil-KoA (ACAA1 dan ACAT2), karboksilasi ke malonyl-CoA, dan berkontribusi pada sintesis asam lemak (Bergstrom et al., 1984; Edmond, 1974; Endemann dkk., 1982; Geelen dkk., 1983; Webber dan Edmond, 1977).
Sementara signifikansi fisiologis belum ditetapkan, keton dapat berfungsi sebagai substrat anabolik bahkan di hati. Dalam konteks eksperimental buatan, AcAc dapat berkontribusi sebanyak setengah dari lipid yang baru disintesis, dan hingga 75% dari kolesterol baru yang disintesis (Endemann et al., 1982; Geelen et al., 1983; Freed et al., 1988). Karena AcAc berasal dari oksidasi lemak hati yang tidak lengkap, kemampuan AcAc untuk berkontribusi pada lipogenesis in vivo akan menyiratkan siklus sia-sia hati, di mana keton yang diturunkan dari lemak dapat digunakan untuk produksi lipid, sebuah gagasan yang signifikansi fisiologisnya memerlukan validasi eksperimental, tetapi dapat berfungsi peran adaptif atau maladaptif (Solinas et al., 2015). AcAc sangat mensuplai kolesterogenesis, dengan AACS Km-AcAc yang rendah (~50 M) mendukung aktivasi AcAc bahkan dalam keadaan makan (Bergstrom et al., 1984). Peran dinamis metabolisme keton sitoplasma telah disarankan dalam neuron embrionik tikus primer dan dalam adiposit turunan 3T3-L1, karena knockdown AACS mengganggu diferensiasi setiap jenis sel (Hasegawa et al., 2012a; Hasegawa et al., 2012b). Knockdown AACS pada tikus in vivo menurunkan kolesterol serum (Hasegawa et al., 2012c). SREBP-2, pengatur transkripsi utama biosintesis kolesterol, dan reseptor teraktivasi proliferator peroksisom (PPAR)-? adalah aktivator transkripsi AACS, dan mengatur transkripsinya selama perkembangan neurit dan di hati (Aguilo et al., 2010; Hasegawa et al., 2012c). Secara bersama-sama, metabolisme tubuh keton sitoplasma mungkin penting dalam kondisi tertentu atau riwayat penyakit, tetapi tidak memadai untuk membuang badan keton yang diturunkan dari hati, karena hiperketonemia masif terjadi dalam pengaturan gangguan selektif nasib oksidatif primer melalui hilangnya fungsi mutasi. ke SCOT (Berry et al., 2001; Cotter et al., 2011).
Peraturan HMGCS2 dan SCOT / OXCT1
Divergensi mitokondria dari gen yang mengkode HMGCS sitosol terjadi pada awal evolusi vertebrata karena kebutuhan untuk mendukung ketogenesis hati pada spesies dengan rasio berat badan dan berat otak yang lebih tinggi (Boukaftane et al., 1994; Cunnane dan Crawford, 2003). Mutasi HMGCS2 yang hilang secara alami pada manusia menyebabkan serangan hipoglikemia hipoketotik (Pitt et al., 2015; Thompson et al., 1997). Robust HMGCS2 ekspresi dibatasi untuk hepatosit dan epitel kolon, dan ekspresinya dan aktivitas enzim dikoordinasikan melalui mekanisme beragam (Mascaro et al., 1995; McGarry dan Foster, 1980; Robinson dan Williamson, 1980). Sementara cakupan penuh keadaan fisiologis yang mempengaruhi HMGCS2 membutuhkan penjelasan lebih lanjut, ekspresi dan / atau aktivitasnya diatur selama periode pascanatal awal, penuaan, diabetes, kelaparan atau konsumsi diet ketogenik (Balasse dan Fery, 1989; Cahill GF Jr, 2006 ; Girard et al., 1992; Hegardt, 1999; Satapati et al., 2012; Sengupta et al., 2010). Pada janin, metilasi 5' daerah mengapit gen Hmgcs2 berkorelasi terbalik dengan transkripsinya, dan sebagian terbalik setelah lahir (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al. ., 1983). Demikian pula, hati Bdh1 menunjukkan pola ekspresi perkembangan, meningkat dari kelahiran ke penyapihan, dan juga diinduksi oleh diet ketogenik dalam faktor pertumbuhan fibroblast (FGF) -21-tergantung cara (Badman et al., 2007; Zhang et al., 1989 ). Ketogenesis pada mamalia sangat responsif terhadap insulin dan glukagon, yang ditekan dan dirangsang, masing-masing (McGarry dan Foster, 1977). Insulin menekan lipolisis jaringan adiposa, sehingga mengurangi ketogenesis substratnya, sementara glukagon meningkatkan fluks ketogenik melalui efek langsung pada hati (Hegardt, 1999). Transkripsi Hmgcs2 dirangsang oleh faktor transkripsi forkhead FOXA2, yang dihambat melalui insulin-phosphatidylinositol-3-kinase / Akt, dan diinduksi oleh pensinyalan glukagon-cAMP-p300 (Arias et al., 1995; Hegardt, 1999; Quant et al. , 1990; Thumelin dkk., 1993; von Meyenn dkk., 2013; Wolfrum dkk., 2004; Wolfrum dkk., 2003). PPAR? (Rodriguez et al., 1994) bersama dengan targetnya, FGF21 (Badman et al., 2007) juga menginduksi transkripsi Hmgcs2 di hati selama kelaparan atau pemberian diet ketogenik (Badman et al., 2007; Inagaki et al., 2007; ). Induksi PPAR? dapat terjadi sebelum transisi dari fisiologi janin ke neonatal, sementara aktivasi FGF21 mungkin lebih disukai pada periode neonatal awal melalui penghambatan histone deacetylase (HDAC) -3 yang dimediasi OHB (Rando et al., 2016). mTORC1 (target mamalia dari kompleks rapamycin 1) tergantung penghambatan PPAR? aktivitas transkripsi juga merupakan pengatur kunci ekspresi gen Hmgcs2 (Sengupta et al., 2010), dan PER2 hati, osilator sirkadian utama, secara tidak langsung mengatur ekspresi Hmgcs2 (Chavan et al., 2016). Pengamatan terbaru menunjukkan bahwa interleukin-6 yang diinduksi tumor ekstrahepatik mengganggu ketogenesis melalui PPAR? penekanan (Flint et al., 2016).
Aktivitas enzim HMGCS2 diatur melalui beberapa PTM. HMGCS2 serine fosforilasi meningkatkan aktivitasnya secara in vitro (Grimsrud et al., 2012). Aktivitas HMGCS2 secara allosterik dihambat oleh suksinilasi succinyl-CoA dan lysine residu (Arias et al., 1995; Hegardt, 1999; Lowe dan Tubbs, 1985; Quant dkk., 1990; Rardin dkk., 2013; Reed et al., 1975; Thumelin dkk., 1993). Succinylation dari HMGCS2, HMGCL, dan BDH1 residu lisin di mitokondria hati adalah target dari NAD + tergantung deacylase sirtuin 5 (SIRT5) (Rardin et al., 2013). Aktivitas HMGCS2 juga ditingkatkan oleh SIRT3 deasetilasi lisin, dan ada kemungkinan bahwa crosstalk antara asetilasi dan succinylation mengatur aktivitas HMGCS2 (Rardin dkk., 2013; Shimazu et al., 2013). Meskipun kemampuan PTM ini untuk mengatur HMGCS2 Km dan Vmax, fluktuasi PTM ini belum dipetakan dengan hati-hati dan belum dikonfirmasi sebagai driver mekanistik dari ketogenesis in vivo.
SCOT diekspresikan pada semua sel mamalia yang mengandung mitokondria, kecuali hepatosit. Pentingnya aktivitas SCOT dan ketolisis ditunjukkan pada tikus SCOT-KO, yang menunjukkan kematian yang seragam karena hipoglikemia hiperklikemik dalam 48h setelah lahir (Cotter et al., 2011). Kehilangan spesifik jaringan SCOT di neuron atau miosit skeletal menginduksi kelainan metabolik selama kelaparan tetapi tidak mematikan (Cotter et al., 2013b). Pada manusia, kekurangan SCOT terjadi pada awal kehidupan dengan ketoasidosis berat, menyebabkan kelesuan, muntah, dan koma (Berry et al., 2001; Fukao dkk., 2000; Kassovska-Bratinova dkk., 1996; Niezen-Koning et al. , 1997; Saudubray dkk., 1987; Snyderman dkk., 1998; Tildon dan Cornblath, 1972). Relatif sedikit diketahui di tingkat sel tentang gen SCOT dan regulator ekspresi protein. Ekspresi mRNA Oxct1 dan SCOT protein dan aktivitas berkurang dalam keadaan ketotis, mungkin melalui mekanisme PPAR-dependent (Fenselau dan Wallis, 1974; Fenselau dan Wallis, 1976; Grinblat dkk., 1986; Okuda dkk., 1991; Turko et al ., 2001; Wentz et al., 2010). Pada ketoasidosis diabetik, ketidaksesuaian antara ketogenesis hati dan oksidasi ekstrahepatik menjadi semakin buruk oleh gangguan aktivitas SCOT. Ekspresi berlebihan transporter glukosa insulin-independen (GLUT1 / SLC2A1) di cardiomyocytes juga menghambat ekspresi gen Oxct1 dan menurunkan regulasi oksidasi terminal keton dalam keadaan non-ketotic (Yan et al., 2009). Dalam hati, kelimpahan mRNA Oxct1 ditekan oleh microRNA-122 dan metilasi histone H3K27me3 yang terbukti selama transisi dari janin ke periode neonatal (Thorrez et al., 2011). Namun, penekanan ekspresi Oxct1 hati pada periode postnatal terutama disebabkan oleh evakuasi dari progenitor hematopoietik oksctxNUMX dari hati, daripada hilangnya ekspresi Oxct1 yang sudah ada sebelumnya pada hepatosit terdiferensiasi. Faktanya, ekspresi mRNA Oxct1 dan protein SCOT pada hepatosit terdiferensiasi sangat rendah (Orii et al., 1).
SCOT juga diatur oleh PTM. Enzim tersebut mengalami hiperasetilasi pada otak tikus SIRT3 KO, yang juga menunjukkan penurunan produksi asetil-KoA yang bergantung pada AcAc (Dittenhafer-Reed et al., 2015). Nitrasi non-enzimatik dari residu tirosin dari SCOT juga melemahkan aktivitasnya, yang telah dilaporkan di jantung berbagai model tikus diabetes (Marcondes et al., 2001; Turko et al., 2001; Wang et al., 2010a). Sebaliknya, nitrasi residu triptofan meningkatkan aktivitas SCOT (Br g re et al., 2010; Rebrin et al., 2007). Mekanisme molekuler dari residu-spesifik nitrasi atau de-nitrasi yang dirancang untuk memodulasi aktivitas SCOT mungkin ada dan memerlukan penjelasan.
Kontroversi dalam Ketogenesis ekstrahepatik
Pada mamalia, organ ketogenik utama adalah hati, dan hanya hepatosit dan sel epitel usus yang mengekspresikan isoform mitokondria HMGCS2 secara berlimpah (Cotter et al., 2013a; Cotter et al., 2014; McGarry dan Foster, 1980; Robinson dan Williamson, 1980) . Fermentasi bakteri anaerobik dari polisakarida kompleks menghasilkan butirat, yang diserap oleh kolonosit pada mamalia untuk oksidasi terminal atau ketogenesis (Cherbuy et al., 1995), yang mungkin berperan dalam diferensiasi kolonosit (Wang et al., 2016). Tidak termasuk sel epitel usus dan hepatosit, HMGCS2 hampir tidak ada di hampir semua sel mamalia lainnya, tetapi prospek ketogenesis ekstrahepatik telah meningkat dalam sel tumor, astrosit dari sistem saraf pusat, ginjal, pankreas? sel, epitel pigmen retinal (RPE), dan bahkan di otot rangka (Adijanto et al., 2014; Avogaro et al., 1992; El Azzouny et al., 2016; Grabacka et al., 2016; Kang et al., 2015 ; Le Foll et al., 2014; Nonaka et al., 2016; Takagi et al., 2016a; Thevenet et al., 2016; Zhang et al., 2011). HMGCS2 ektopik telah diamati pada jaringan yang tidak memiliki kapasitas ketogenik bersih (Cook et al., 2016; Wentz et al., 2010), dan HMGCS2 menunjukkan aktivitas `` penerangan bulan '' yang tidak bergantung pada ketogenesis, termasuk di dalam inti sel (Chen et al. , 2016; Kostiuk et al., 2010; Meertens et al., 1998).
Setiap jaringan ekstrahepatik yang mengoksidasi badan keton juga berpotensi mengakumulasi badan keton melalui mekanisme independen HMGCS2 (Gbr. 2A). Namun, tidak ada jaringan ekstrahepatik di mana konsentrasi tubuh keton keadaan mapan melebihi yang ada di sirkulasi (Cotter et al., 2011; Cotter et al., 2013b; Harrison dan Long, 1940), menggarisbawahi bahwa badan keton diangkut ke a gradien konsentrasi melalui mekanisme yang bergantung pada MCT1 / 2. Salah satu mekanisme ketogenesis ekstrahepatik sebenarnya dapat mencerminkan kerusakan relatif dari oksidasi keton. Penjelasan potensial tambahan termasuk dalam bidang pembentukan tubuh keton. Pertama, ketogenesis de novo dapat terjadi melalui aktivitas enzimatik yang reversibel dari tiolase dan SCOT (Weidemann dan Krebs, 1969). Ketika konsentrasi asetil-KoA relatif tinggi, reaksi yang biasanya bertanggung jawab atas oksidasi AcAc beroperasi ke arah sebaliknya (GOLDMAN, 1954). Mekanisme kedua terjadi ketika? -Oksidasi yang diturunkan intermediet terakumulasi karena kemacetan siklus TCA, AcAc-CoA diubah menjadi l-? OHB-CoA melalui reaksi yang dikatalisasi oleh mitokondria 3-hidroksiasil-KoA dehidrogenase, dan selanjutnya oleh 3-hidroksibutiril CoA deacylase menjadi l-? OHB, yang tidak dapat dibedakan dengan spektrometri massa atau spektroskopi resonansi dari enansiomer fisiologis d-? OHB (Reed dan Ozand, 1980). l-? OHB dapat dibedakan secara kromatografi atau enzimatis dari d-? OHB, dan terdapat di jaringan ekstrahepatik, tetapi tidak di hati atau darah (Hsu et al., 2011). Ketogenesis hati hanya menghasilkan d-? OHB, satu-satunya enansiomer yang merupakan substrat BDH (Ito et al., 1984; Lincoln et al., 1987; Reed dan Ozand, 1980; Scofield et al., 1982; Scofield et al., 1982). Mekanisme independen HMGCS2 ketiga menghasilkan d-? OHB melalui katabolisme asam amino, terutama leusin dan lisin. Mekanisme keempat hanya terlihat karena disebabkan oleh artefak pelabelan dan dengan demikian disebut pseudoketogenesis. Fenomena ini disebabkan oleh reversibilitas reaksi SCOT dan tiolase, dan dapat menyebabkan overestimasi pergantian tubuh keton karena pengenceran isotop pelacak tubuh keton dalam jaringan ekstrahepatik (Des Rosiers et al., 1990; Fink et al., 1988) . Meskipun demikian, pseudoketogenesis dapat diabaikan dalam banyak konteks (Bailey et al., 1990; Keller et al., 1978). Skema (Gbr. 2A) menunjukkan pendekatan yang berguna untuk diterapkan sambil mempertimbangkan konsentrasi keton pada kondisi tunak jaringan yang ditinggikan.
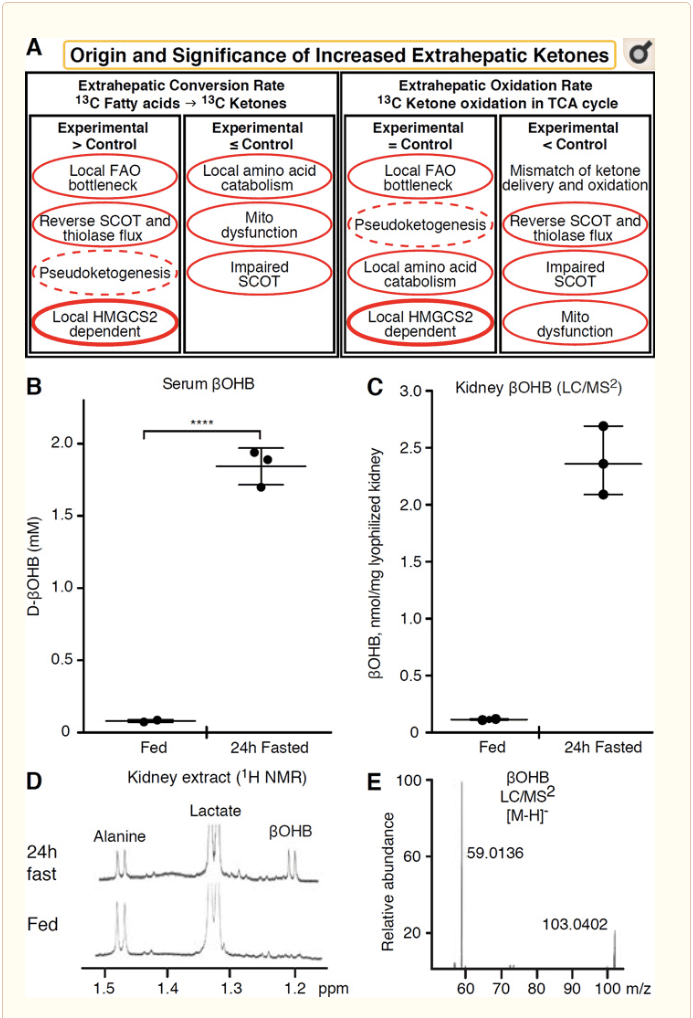

Ginjal baru-baru ini mendapat perhatian sebagai organ yang berpotensi ketogenik. Di sebagian besar negara bagian, ginjal adalah konsumen bersih badan keton yang diturunkan dari hati, mengekskresikan atau menyerap kembali badan keton dari aliran darah, dan ginjal umumnya bukan penghasil atau konsentrator badan keton bersih (Robinson dan Williamson, 1980). Penulis studi klasik menyimpulkan bahwa ketogenesis ginjal minimal yang diukur dalam sistem eksperimental buatan tidak relevan secara fisiologis (Weidemann dan Krebs, 1969). Baru-baru ini, ketogenesis ginjal telah disimpulkan pada model tikus yang kekurangan diabetes dan autophagy, tetapi lebih mungkin bahwa pergeseran multi-organ dalam homeostasis metabolik mengubah metabolisme keton integratif melalui input pada banyak organ (Takagi et al., 2016a; Takagi et al., 2016b; Zhang et al., 2011). Satu publikasi baru-baru ini menyarankan ketogenesis ginjal sebagai mekanisme perlindungan terhadap cedera iskemia-reperfusi di ginjal (Tran et al., 2016). Konsentrasi mutlak ?OHB dari ekstrak jaringan ginjal tikus dilaporkan pada ~4-12 mM. Untuk menguji apakah ini dapat dipertahankan, kami menghitung konsentrasi ?OHB dalam ekstrak ginjal dari tikus yang diberi makan dan puasa 24 jam. Konsentrasi ?OHB serum meningkat dari ~100 M menjadi 2 mM dengan puasa 24 jam (Gbr. 2B), sedangkan konsentrasi ?OHB kondisi ginjal stabil mendekati 100 M dalam keadaan makan, dan hanya 1 mM dalam keadaan puasa 24 jam (Gbr. 2C�E), pengamatan yang konsisten dengan konsentrasi yang diukur lebih dari 45 tahun yang lalu (Hems dan Brosnan, 1970). Masih mungkin bahwa dalam keadaan ketotik, badan keton yang diturunkan dari hati dapat bersifat renoprotektif, tetapi bukti untuk ketogenesis ginjal memerlukan pembuktian lebih lanjut. Bukti kuat yang mendukung ketogenesis ekstrahepatik sejati disajikan dalam RPE (Adijanto et al., 2014). Transformasi metabolik yang menarik ini disarankan untuk berpotensi memungkinkan keton yang diturunkan dari RPE mengalir ke fotoreseptor atau sel glia Müller, yang dapat membantu regenerasi segmen luar fotoreseptor.
? OHB sebagai Mediator Persinyalan
Meskipun mereka kaya energi, badan keton mengerahkan peran pensinyalan 'non-kanonik' yang provokatif dalam homeostasis seluler (Gbr. 3) (Newman dan Verdin, 2014; Rojas-Morales et al., 2016). Misalnya, ?OHB menghambat HDAC Kelas I, yang meningkatkan asetilasi histon dan dengan demikian menginduksi ekspresi gen yang mengurangi stres oksidatif (Shimazu et al., 2013). ?OHB sendiri adalah pengubah kovalen histon pada residu lisin di hati tikus diabetes yang dipuasakan atau diinduksi streptozotocin (Xie et al., 2016) (lihat juga di bawah, Integrasi metabolisme tubuh keton, modifikasi pasca-translasi, dan fisiologi sel, dan Badan keton, stres oksidatif, dan pelindung saraf).
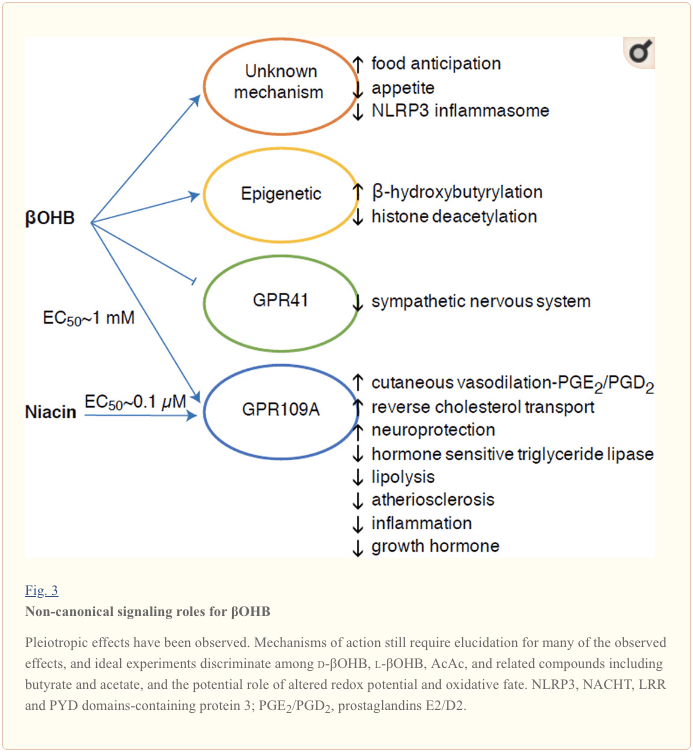
?OHB juga merupakan efektor melalui reseptor berpasangan G-protein. Melalui mekanisme molekuler yang tidak jelas, ia menekan aktivitas sistem saraf simpatik dan mengurangi pengeluaran energi total dan detak jantung dengan menghambat pensinyalan asam lemak rantai pendek melalui reseptor berpasangan protein G 41 (GPR41) (Kimura et al., 2011). Salah satu efek pensinyalan yang paling banyak dipelajari dari ?OHB berlangsung melalui GPR109A (juga dikenal sebagai HCAR2), anggota sub-famili GPCR asam hidrokarboksilat yang diekspresikan dalam jaringan adiposa (putih dan coklat) (Tunaru et al., 2003), dan dalam sel imun (Ahmed et al., 2009). ?OHB adalah satu-satunya ligan endogen yang diketahui dari reseptor GPR109A (EC50 ~770 M) yang diaktifkan oleh d-?OHB, l-?OHB, dan butirat, tetapi bukan AcAc (Taggart et al., 2005). Ambang konsentrasi tinggi untuk aktivasi GPR109A dicapai melalui kepatuhan terhadap diet ketogenik, kelaparan, atau selama ketoasidosis, yang mengarah pada penghambatan lipolisis jaringan adiposa. Efek anti-lipolitik dari GPR109A berlangsung melalui penghambatan adenilil siklase dan penurunan cAMP, menghambat lipase trigliserida yang sensitif terhadap hormon (Ahmed et al., 2009; Tunaru et al., 2003). Ini menciptakan umpan balik negatif di mana ketosis menempatkan rem modulasi pada ketogenesis dengan mengurangi pelepasan asam lemak non-esterifikasi dari adiposit (Ahmed et al., 2009; Taggart et al., 2005), efek yang dapat diimbangi dengan dorongan simpatis yang merangsang lipolisis. Niasin (vitamin B3, asam nikotinat) adalah ligan kuat (EC50 ~ 0.1 M) untuk GRP109A, efektif digunakan selama beberapa dekade untuk dislipidemia (Benyo et al., 2005; Benyo et al., 2006; Fabbrini et al., 2010a; Lukasova dkk., 2011; Tunaru dkk., 2003). Sementara niasin meningkatkan transpor kolesterol terbalik dalam makrofag dan mengurangi lesi aterosklerotik (Lukasova et al., 2011), efek ?OHB pada lesi aterosklerotik masih belum diketahui. Meskipun reseptor GPR109A memberikan peran protektif, dan ada hubungan menarik antara penggunaan diet ketogenik pada stroke dan penyakit neurodegeneratif (Fu et al., 2015; Rahman et al., 2014), peran protektif ?OHB melalui GPR109A belum ditunjukkan secara in vivo .
Akhirnya, ?OHB dapat mempengaruhi nafsu makan dan rasa kenyang. Sebuah studi meta-analisis yang mengukur efek dari diet ketogenik dan sangat rendah energi menyimpulkan bahwa peserta yang mengonsumsi diet ini menunjukkan rasa kenyang yang lebih tinggi, dibandingkan dengan diet kontrol (Gibson et al., 2015). Namun, penjelasan yang masuk akal untuk efek ini adalah elemen metabolik atau hormonal tambahan yang mungkin memodulasi nafsu makan. Misalnya, tikus yang dipelihara dengan diet ketogenik hewan pengerat menunjukkan peningkatan pengeluaran energi dibandingkan dengan tikus yang diberi makan kontrol chow, meskipun asupan kalorinya sama, dan leptin atau gen peptida yang bersirkulasi yang mengatur perilaku makan tidak berubah (Kennedy et al., 2007). Di antara mekanisme yang diusulkan yang menyarankan penekanan nafsu makan oleh ?OHB termasuk pensinyalan dan oksidasi (Laeger et al., 2010). Penghapusan spesifik hepatosit dari gen ritme sirkadian (Per2) dan studi imunopresipitasi kromatin mengungkapkan bahwa PER2 secara langsung mengaktifkan gen Cpt1a, dan secara tidak langsung mengatur Hmgcs2, yang menyebabkan gangguan ketosis pada tikus knockout Per2 (Chavan et al., 2016). Tikus-tikus ini menunjukkan gangguan antisipasi makanan, yang sebagian dipulihkan dengan pemberian ?OHB sistemik. Studi masa depan akan diperlukan untuk mengkonfirmasi sistem saraf pusat sebagai target ?OHB langsung, dan apakah oksidasi keton diperlukan untuk efek yang diamati, atau apakah mekanisme pensinyalan lain terlibat. Peneliti lain telah menggunakan kemungkinan ketogenesis yang diturunkan dari astrosit lokal dalam hipotalamus ventromedial sebagai pengatur asupan makanan, tetapi pengamatan awal ini juga akan mendapat manfaat dari penilaian berbasis genetik dan fluks (Le Foll et al., 2014). Hubungan antara ketosis dan kekurangan nutrisi tetap menarik karena rasa lapar dan kenyang merupakan elemen penting dalam upaya penurunan berat badan yang gagal.
Integrasi Metabolisme Tubuh Keton, Modifikasi Pasca-Terjemahan, dan Fisiologi Sel
Badan-badan keton berkontribusi pada kumpulan-kumpulan asetil-CoA yang terkotak, suatu perantara kunci yang menunjukkan peran-peran penting dalam metabolisme sel (Pietrocola et al., 2015). Salah satu peran asetil-CoA adalah berfungsi sebagai substrat untuk asetilasi, modifikasi histone kovalen enzimatik katalis (Choudhary et al., 2014; Dutta dkk., 2016; Fan dkk., 2015; Menzies et al., 2016 ). Sejumlah besar protein mitokondria yang diasetilasi secara dinamis, banyak yang mungkin terjadi melalui mekanisme non-enzimatik, juga muncul dari studi proteomik komputasional (Dittenhafer-Reed dkk., 2015; Hebert dkk., 2013; Rardin et al., 2013 ; Shimazu et al., 2010). Deacetylases lisin menggunakan kofaktor seng (misalnya, HDAC nukleosytosol) atau NAD + sebagai co-substrat (sirtuins, SIRTs) (Choudhary et al., 2014; Menzies et al., 2016). Asetilproteom berfungsi baik sebagai sensor dan efektor dari total seluler asetil-CoA, sebagai manipulasi fisiologis dan genetik masing-masing menghasilkan variasi global non-enzimatik dari asetilasi (Weinert et al., 2014). Sebagai metabolit intraseluler berfungsi sebagai modulator asetilasi sisa lisin, penting untuk mempertimbangkan peran badan keton, yang kelimpahannya sangat dinamis.
OHB adalah pengubah epigenetik melalui setidaknya dua mekanisme. Peningkatan? Kadar OHB yang disebabkan oleh puasa, pembatasan kalori, pemberian langsung atau olahraga berkepanjangan memicu penghambatan HDAC atau aktivasi asetiltransferase histon (Marosi et al., 2016; Sleiman et al., 2016) atau stres oksidatif (Shimazu et al., 2013) . Penghambatan OHB HDAC3 dapat mengatur fisiologi metabolik bayi baru lahir (Rando et al., 2016). Secara independen,? OHB sendiri secara langsung memodifikasi residu lisin histon (Xie et al., 2016). Puasa berkepanjangan, atau ketoasidosis diabetik yang diinduksi steptozotocin meningkatkan histone? -Hydroxybutyrylation. Meskipun jumlah situs lisin -hidroksibutirilasi dan asetilasi sebanding, histon-hidroksibutirilasi secara stoikiometri lebih besar daripada asetilasi. Gen yang berbeda dipengaruhi oleh histone lysine? -Hydroxybutyrylation, versus asetilasi atau metilasi, menunjukkan fungsi seluler yang berbeda. Apakah? -Hidroksibutirilasi bersifat spontan atau enzimatik tidak diketahui, tetapi memperluas cakupan mekanisme melalui badan keton yang secara dinamis memengaruhi transkripsi.
Peristiwa pemrograman ulang sel penting selama pembatasan kalori dan kekurangan nutrisi dapat dimediasi dalam deasetilasi dan desuksinilasi mitokondria yang bergantung pada SIRT3 dan SIRT5, masing-masing, mengatur protein ketogenik dan ketolitik pada tingkat pasca-translasi di jaringan hati dan ekstrahepatik (Dittenhafer-Reed et al., 2015; Hebert dkk., 2013; Rardin dkk., 2013; Shimazu dkk., 2010). Meskipun perbandingan stoikiometri dari situs yang ditempati tidak selalu terkait langsung dengan perubahan fluks metabolik, asetilasi mitokondria bersifat dinamis dan dapat didorong oleh konsentrasi asetil-KoA atau pH mitokondria, daripada asetiltransferase enzimatik (Wagner dan Payne, 2013). SIRT3 dan SIRT5 memodulasi aktivitas enzim metabolisme tubuh keton memicu pertanyaan tentang peran timbal balik keton dalam memahat asetilproteom, succinylproteome, dan target seluler dinamis lainnya. Memang, karena variasi ketogenesis mencerminkan konsentrasi NAD +, produksi dan kelimpahan keton dapat mengatur aktivitas sirtuin, sehingga mempengaruhi kumpulan asetil-KoA / suksinil-KoA total, asilproteom, dan dengan demikian mitokondria dan fisiologi sel. -hidroksibutirilasi residu enzim lisin dapat menambah lapisan lain untuk pemrograman ulang seluler. Pada jaringan ekstrahepatik, oksidasi tubuh keton dapat merangsang perubahan serupa dalam homeostasis sel. Sementara kompartmentasi kumpulan asetil-KoA sangat diatur dan mengoordinasikan spektrum perubahan seluler yang luas, kemampuan badan keton untuk secara langsung membentuk konsentrasi asetil-KoA mitokondria dan sitoplasma memerlukan penjelasan (Chen et al., 2012; Corbet et al., 2016; Pougovkina et al., 2014; Schwer et al., 2009; Wellen dan Thompson, 2012). Karena konsentrasi asetil-KoA diatur secara ketat, dan asetil-KoA adalah membran impermeant, penting untuk mempertimbangkan mekanisme pendorong yang mengoordinasikan homeostasis asetil-KoA, termasuk laju produksi dan oksidasi terminal dalam siklus TCA, konversi menjadi badan keton, mitokondria pengeluaran melalui karnitin asetiltransferase (CrAT), atau ekspor asetil-KoA ke sitosol setelah konversi menjadi sitrat dan dilepaskan oleh ATP sitrat lyase (ACLY). Peran kunci dari mekanisme terakhir ini dalam asetilproteom sel dan homeostasis memerlukan pemahaman yang sesuai tentang peran ketogenesis dan oksidasi keton (Das et al., 2015; McDonnell et al., 2016; Moussaieff et al., 2015; Overmyer et al., 2015; Seiler et al., 2014; Seiler et al., 2015; Wellen et al., 2009; Wellen dan Thompson, 2012). Teknologi konvergen dalam metabolomik dan asilproteomik dalam pengaturan model yang dimanipulasi secara genetik akan diperlukan untuk menentukan target dan hasil.
Respon Anti dan Pro-Inflamasi terhadap Ketone Bodies
Badan ketosis dan keton memodulasi peradangan dan fungsi sel kekebalan, tetapi berbagai mekanisme dan bahkan perbedaan telah diusulkan. Kekurangan nutrisi yang berkepanjangan mengurangi peradangan (Youm et al., 2015), tetapi ketosis kronis diabetes tipe 1 adalah keadaan pro-inflamasi (Jain et al., 2002; Kanikarla-Marie dan Jain, 2015; Kurepa et al., 2012 ). Peran pensinyalan berbasis mekanisme untuk OHB dalam inflamasi muncul karena banyak sel sistem kekebalan, termasuk makrofag atau monosit, mengekspresikan GPR109A secara melimpah. Sementara? OHB memberikan respon anti-inflamasi yang dominan (Fu et al., 2014; Gambhir et al., 2012; Rahman et al., 2014; Youm et al., 2015), konsentrasi tinggi badan keton, terutama AcAc, dapat memicu respons pro-inflamasi (Jain et al., 2002; Kanikarla-Marie dan Jain, 2015; Kurepa et al., 2012).
Peran anti-inflamasi dari ligan GPR109A dalam aterosklerosis, obesitas, penyakit radang usus, penyakit neurologis, dan kanker telah ditinjau (Graff et al., 2016). Ekspresi GPR109A ditambah dalam sel RPE model diabetes, pasien diabetes manusia (Gambhir et al., 2012), dan mikroglia selama neurodegenerasi (Fu et al., 2014). Efek anti-inflamasi dari? OHB ditingkatkan oleh ekspresi berlebih GPR109A dalam sel RPE, dan dibatalkan oleh penghambatan farmakologis atau knockout genetik GPR109A (Gambhir et al., 2012). ? OHB dan asam nikotinat eksogen (Taggart et al., 2005), keduanya memberikan efek anti-inflamasi pada TNF? atau peradangan yang diinduksi LPS dengan menurunkan kadar protein pro-inflamasi (iNOS, COX-2), atau sitokin yang disekresikan (TNF ?, IL-1 ?, IL-6, CCL2 / MCP-1), sebagian melalui penghambatan NF -? B translokasi (Fu et al., 2014; Gambhir et al., 2012). OHB menurunkan stres ER dan inflamasi NLRP3, mengaktifkan respon stres antioksidan (Bae et al., 2016; Youm et al., 2015). Namun, pada inflamasi neurodegeneratif, proteksi yang dimediasi GPR109A tergantung? OHB tidak melibatkan mediator inflamasi seperti pensinyalan jalur MAPK (mis., ERK, JNK, p38) (Fu et al., 2014), tetapi mungkin memerlukan PGD1 yang bergantung pada COX-2 produksi (Rahman et al., 2014). Menarik bahwa makrofag GPR109A diperlukan untuk memberikan efek pelindung saraf dalam model stroke iskemik (Rahman et al., 2014), tetapi kemampuan? OHB untuk menghambat inflamasi NLRP3 dalam makrofag yang berasal dari sumsum tulang adalah independen GPR109A (Youm et al. ., 2015). Meskipun sebagian besar penelitian menghubungkan? OHB dengan efek anti-inflamasi,? OHB mungkin bersifat pro-inflamasi dan meningkatkan penanda peroksidasi lipid pada hepatosit betis (Shi et al., 2014). Efek anti-versus pro-inflamasi dari OHB dapat bergantung pada jenis sel, konsentrasi OHB, durasi paparan, dan ada atau tidak adanya ko-modulator.
Tidak seperti? OHB, AcAc dapat mengaktifkan pensinyalan pro-inflamasi. Peningkatan AcAc, terutama dengan konsentrasi glukosa yang tinggi, meningkatkan cedera sel endotel melalui mekanisme NADPH oksidase / stres oksidatif yang bergantung pada mekanisme (Kanikarla-Marie dan Jain, 2015). Konsentrasi AcAc yang tinggi pada tali pusat ibu diabetes berkorelasi dengan laju oksidasi protein dan konsentrasi MCP-1 yang lebih tinggi (Kurepa et al., 2012). AcAc tinggi pada pasien diabetes berkorelasi dengan TNF? ekspresi (Jain et al., 2002), dan AcAc, tetapi tidak? OHB, diinduksi TNF ?, ekspresi MCP-1, akumulasi ROS, dan penurunan level cAMP dalam sel monosit manusia U937 (Jain et al., 2002; Kurepa et al. ., 2012).
Fenomena pensinyalan yang bergantung pada tubuh keton sering dipicu hanya dengan konsentrasi tubuh keton yang tinggi (> 5 mM), dan dalam banyak penelitian yang menghubungkan keton dengan efek pro- atau anti-inflamasi, melalui mekanisme yang tidak jelas. Selain itu, karena efek kontradiktif dari? OHB versus AcAc pada peradangan, dan kemampuan rasio AcAc /? OHB untuk mempengaruhi potensi redoks mitokondria, eksperimen terbaik yang menilai peran badan keton pada fenotipe seluler membandingkan efek AcAc dan? OHB dalam berbagai rasio, dan pada berbagai konsentrasi kumulatif [misalnya, (Saito et al., 2016)]. Akhirnya, AcAc dapat dibeli secara komersial hanya sebagai garam litium atau sebagai etil ester yang memerlukan hidrolisis basa sebelum digunakan. Kation litium secara independen menginduksi kaskade transduksi sinyal (Manji et al., 1995), dan anion AcAc labil. Akhirnya, studi menggunakan rasemat d / l-? OHB dapat dibingungkan, karena hanya stereoisomer d-? OHB yang dapat dioksidasi menjadi AcAc, tetapi d-? OHB dan l-? OHB masing-masing dapat memberikan sinyal melalui GPR109A, menghambat inflamasi NLRP3, dan berfungsi sebagai substrat lipogenik.
Badan Keton, Stres oksidatif, dan pelindung saraf
Stres oksidatif biasanya didefinisikan sebagai keadaan di mana ROS disajikan secara berlebihan, karena produksi yang berlebihan dan/atau gangguan eliminasi. Peran antioksidan dan mitigasi stres oksidatif dari badan keton telah banyak dijelaskan baik in vitro dan in vivo, khususnya dalam konteks pelindung saraf. Karena sebagian besar neuron tidak secara efektif menghasilkan fosfat berenergi tinggi dari asam lemak, tetapi mengoksidasi badan keton ketika pasokan karbohidrat terbatas, efek neuroprotektif badan keton sangat penting (Cahill GF Jr, 2006; Edmond et al., 1987; Yang dkk., 1987). Dalam model stres oksidatif, induksi BDH1 dan penekanan SCOT menunjukkan bahwa metabolisme tubuh keton dapat diprogram ulang untuk mempertahankan pensinyalan sel yang beragam, potensi redoks, atau kebutuhan metabolisme (Nagao et al., 2016; Tieu et al., 2003).
Badan keton menurunkan tingkat kerusakan sel, cedera, kematian dan apoptosis yang lebih rendah pada neuron dan kardiomiosit (Haces et al., 2008; Maalouf et al., 2007; Nagao et al., 2016; Tieu et al., 2003). Mekanisme yang diminta bervariasi dan tidak selalu berhubungan linier dengan konsentrasi. Konsentrasi milimolar rendah (d atau l) -? OHB mengais ROS (anion hidroksil), sedangkan AcAc memulung banyak spesies ROS, tetapi hanya pada konsentrasi yang melebihi kisaran fisiologis (IC50 20 67 mM) (Haces et al., 2008) . Sebaliknya, pengaruh menguntungkan atas potensi redoks rantai transpor elektron adalah mekanisme yang umumnya terkait dengan d-? OHB. Sementara ketiga badan keton (d / l-? OHB dan AcAc) mengurangi kematian sel saraf dan akumulasi ROS yang dipicu oleh penghambatan kimiawi glikolisis, hanya d-? OHB dan AcAc yang mencegah penurunan ATP neuron. Sebaliknya, dalam model hipoglikemik in vivo, (d atau l) -? OHB, tetapi tidak AcAc mencegah peroksidasi lipid hipokampus (Haces et al., 2008; Maalouf et al., 2007; Marosi et al., 2016; Murphy, 2009 ; Tieu et al., 2003). Studi in vivo pada tikus yang diberi diet ketogenik (87% kkal lemak dan 13% protein) menunjukkan variasi neuroanatomis dari kapasitas antioksidan (Ziegler et al., 2003), di mana perubahan yang paling besar diamati pada hipokampus, dengan peningkatan glutathione peroksidase dan total kapasitas antioksidan.
Diet ketogenik, keton ester (juga lihat Penggunaan terapeutik dari diet ketogenik dan badan keton eksogen), atau? Pemberian OHB menggunakan pelindung saraf dalam model stroke iskemik (Rahman et al., 2014); Penyakit Parkinson (Tieu et al., 2003); kejang keracunan oksigen sistem saraf pusat (D'Agostino et al., 2013); kejang epilepsi (Yum et al., 2015); Ensefalomiopati mitokondria, asidosis laktat dan sindrom episode mirip stroke (MELAS) (Frey et al., 2016) dan penyakit Alzheimer (Cunnane dan Crawford, 2003; Yin et al., 2016). Sebaliknya, laporan terbaru menunjukkan bukti histopatologis perkembangan neurodegeneratif oleh diet ketogenik pada model tikus transgenik dari perbaikan DNA mitokondria yang abnormal, meskipun terdapat peningkatan dalam biogenesis mitokondria dan tanda tangan antioksidan (Lauritzen et al., 2016). Laporan lain yang bertentangan menunjukkan bahwa paparan konsentrasi tubuh keton yang tinggi menimbulkan stres oksidatif. Dosis tinggi? OHB atau AcAc diinduksi sekresi oksida nitrat, peroksidasi lipid, penurunan ekspresi SOD, glutathione peroksidase dan katalase dalam hepatosit betis, sedangkan pada hepatosit tikus induksi jalur MAPK dikaitkan dengan AcAc tetapi tidak? OHB (Abdelmegeed et al., 2004 ; Shi et al., 2014; Shi et al., 2016).
Secara keseluruhan, sebagian besar laporan mengaitkan? OHB dengan atenuasi stres oksidatif, karena administrasi menghambat produksi ROS / superoksida, mencegah peroksidasi lipid dan oksidasi protein, meningkatkan kadar protein antioksidan, dan meningkatkan respirasi mitokondria dan produksi ATP (Abdelmegeed et al., 2004; Haces dkk., 2008; Jain dkk., 1998; Jain dkk., 2002; Kanikarla-Marie dan Jain, 2015; Maalouf dkk., 2007; Maalouf dan Rho, 2008; Marosi dkk., 2016; Tieu dkk., 2003; Yin dkk., 2016; Ziegler dkk., 2003). Sementara AcAc lebih berkorelasi langsung daripada? OHB dengan induksi stres oksidatif, efek ini tidak selalu mudah dibedah dari respon pro-inflamasi prospektif (Jain et al., 2002; Kanikarla-Marie dan Jain, 2015; Kanikarla-Marie dan Jain, 2016). Selain itu, penting untuk mempertimbangkan bahwa manfaat antioksidan nyata yang diberikan oleh diet ketogenik pleiotropik mungkin tidak ditransduksi oleh badan keton itu sendiri, dan pelindung saraf yang diberikan oleh badan keton mungkin tidak sepenuhnya disebabkan oleh stres oksidatif. Misalnya selama kekurangan glukosa, dalam model kekurangan glukosa di neuron kortikal, OHB merangsang fluks autofagik dan mencegah akumulasi autofagosom, yang dikaitkan dengan penurunan kematian neuron (Camberos-Luna et al., 2016). d-? OHB juga menginduksi protein antioksidan kanonik FOXO3a, SOD, MnSOD, dan katalase, secara prospektif melalui penghambatan HDAC (Nagao et al., 2016; Shimazu et al., 2013).
Penyakit Hati Lemak Non-Alkohol (NAFLD) dan Metabolisme Tubuh Keton
NAFLD terkait obesitas dan steatohepatitis nonalkohol (NASH) adalah penyebab paling umum penyakit hati di negara-negara Barat (Rinella dan Sanyal, 2016), dan gagal hati yang diinduksi NASH adalah salah satu alasan paling umum untuk transplantasi hati. Sementara penyimpanan berlebih triasilgliserol dalam hepatosit> 5% berat hati (NAFL) saja tidak menyebabkan fungsi hati degeneratif, perkembangan NAFLD pada manusia berkorelasi dengan resistensi insulin sistemik dan peningkatan risiko diabetes tipe 2, dan dapat berkontribusi pada patogenesis penyakit kardiovaskular dan penyakit ginjal kronis (Fabbrini et al., 2009; Targher et al., 2010; Targher dan Byrne, 2013). Mekanisme patogenik NAFLD dan NASH tidak sepenuhnya dipahami tetapi termasuk kelainan metabolisme hepatosit, autofagi hepatosit dan stres retikulum endoplasma, fungsi sel imun hati, inflamasi jaringan adiposa, dan mediator inflamasi sistemik (Fabbrini et al., 2009; Masuoka dan Chalasani, 2013 ; Targher et al., 2010; Yang et al., 2010). Gangguan metabolisme karbohidrat, lipid, dan asam amino terjadi dan berkontribusi pada obesitas, diabetes, dan NAFLD pada manusia dan organisme model [ditinjau dalam (Farese et al., 2012; Lin dan Accili, 2011; Newgard, 2012; Samuel dan Shulman, 2012; Sun dan Lazar, 2013)]. Sementara kelainan hepatosit dalam metabolisme lipid sitoplasma umumnya diamati di NAFLD (Fabbrini et al., 2010b), peran metabolisme mitokondria, yang mengatur pembuangan lemak oksidatif kurang jelas dalam patogenesis NAFLD. Abnormalitas metabolisme mitokondria terjadi di dan berkontribusi pada patogenesis NAFLD / NASH (Hyotylainen et al., 2016; Serviddio et al., 2011; Serviddio et al., 2008; Wei et al., 2008). Ada yang umum (Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011) tetapi tidak seragam ( Koliaki dan Roden, 2013; Perry et al., 2016; Rector et al., 2010) konsensus bahwa, sebelum pengembangan NASH yang bonafid, oksidasi mitokondria hati, dan khususnya oksidasi lemak, bertambah pada obesitas, resistensi insulin sistemik , dan NAFLD. Tampaknya seiring dengan kemajuan NAFLD, heterogenitas kapasitas oksidatif, bahkan di antara mitokondria individu, muncul, dan pada akhirnya fungsi oksidatif menjadi terganggu (Koliaki et al., 2015; Rector et al., 2010; Satapati et al., 2008; Satapati et al., 2012; Satapati et al., XNUMX; Satapati et al. ., XNUMX).
Ketogenesis sering digunakan sebagai proksi untuk oksidasi lemak hati. Gangguan ketogenesis muncul saat NAFLD berkembang pada model hewan, dan kemungkinan besar pada manusia. Melalui mekanisme yang tidak didefinisikan secara lengkap, hiperinsulinemia menekan ketogenesis, kemungkinan berkontribusi pada hipoketonemia dibandingkan dengan kontrol tanpa lemak (Bergman et al., 2007; Bickerton et al., 2008; Satapati et al., 2012; Soeters et al., 2009; Sunny et al. , 2011; Vice et al., 2005). Meskipun demikian, kemampuan konsentrasi tubuh keton yang bersirkulasi untuk memprediksi NAFLD masih kontroversial (M nnist et al., 2015; Sanyal et al., 2001). Metode spektroskopi resonansi magnetik kuantitatif yang kuat pada model hewan menunjukkan peningkatan tingkat pergantian keton dengan resistensi insulin sedang, tetapi penurunan tingkat terbukti dengan resistensi insulin yang lebih parah (Satapati et al., 2012; Sunny et al., 2010). Pada manusia obesitas dengan perlemakan hati, tingkat ketogenik normal (Bickerton et al., 2008; Sunny et al., 2011), dan karenanya, tingkat ketogenesis berkurang relatif terhadap peningkatan asam lemak dalam hepatosit. Akibatnya,? -Oksidasi yang diturunkan asetil-KoA dapat diarahkan ke oksidasi terminal dalam siklus TCA, meningkatkan oksidasi terminal, glukoneogenesis yang digerakkan oleh fosfoenolpiruvat melalui anaplerosis / cataplerosis, dan stres oksidatif. Asetil-KoA juga mungkin mengalami ekspor dari mitokondria sebagai sitrat, substrat prekursor untuk lipogenesis (Gambar 4) (Satapati et al., 2015; Satapati et al., 2012; Solinas et al., 2015). Sementara ketogenesis menjadi kurang responsif terhadap insulin atau puasa dengan obesitas berkepanjangan (Satapati et al., 2012), mekanisme yang mendasari dan konsekuensi hilir dari hal ini masih belum sepenuhnya dipahami. Bukti terbaru menunjukkan bahwa mTORC1 menekan ketogenesis dengan cara yang mungkin terjadi di hilir pensinyalan insulin (Kucejova et al., 2016), yang sejalan dengan pengamatan bahwa mTORC1 menghambat induksi Hmgcs2 yang dimediasi PPAR? (Sengupta et al., 2010) ( lihat juga Peraturan HMGCS2 dan SCOT / OXCT1).

Pengamatan awal dari kelompok kami menunjukkan konsekuensi hati yang merugikan dari ketidakcukupan ketogenik (Cotter et al., 2014). Untuk menguji hipotesis bahwa gangguan ketogenesis, bahkan dalam keadaan penuh karbohidrat dan dengan demikian 'non-ketogenik', berkontribusi pada metabolisme glukosa yang abnormal dan memicu steatohepatitis, kami membuat model tikus dengan ketidakcukupan ketogenik yang ditandai dengan pemberian antisense oligonucleotides (ASO) yang ditargetkan untuk Hmgcs2. Hilangnya HMGCS2 pada tikus dewasa yang diberi makan makanan rendah lemak standar menyebabkan hiperglikemia ringan dan secara nyata meningkatkan produksi ratusan metabolit hati, rangkaian yang sangat menyarankan aktivasi lipogenesis. Pemberian pakan tikus dengan diet tinggi lemak dengan ketogenesis yang tidak mencukupi mengakibatkan cedera dan inflamasi hepatosit yang luas. Temuan ini mendukung hipotesis utama bahwa (i) ketogenesis bukanlah jalur luapan pasif melainkan simpul dinamis dalam homeostasis fisiologis hati dan terintegrasi, dan (ii) augmentasi ketogenik yang bijaksana untuk mengurangi NAFLD / NASH dan gangguan metabolisme glukosa hati layak untuk dieksplorasi. .
Bagaimana gangguan ketogenesis berkontribusi pada kerusakan hati dan perubahan homeostasis glukosa? Pertimbangan pertama adalah apakah pelakunya adalah defisiensi fluks ketogenik, atau keton itu sendiri. Sebuah laporan baru-baru ini menunjukkan bahwa badan keton dapat mengurangi cedera hati akibat stres oksidatif sebagai respons terhadap asam lemak tak jenuh ganda n-3 (Pawlak et al., 2015). Ingatlah bahwa karena kurangnya ekspresi SCOT dalam hepatosit, badan keton tidak teroksidasi, tetapi mereka dapat berkontribusi pada lipogenesis, dan melayani berbagai peran pensinyalan terlepas dari oksidasi mereka (lihat juga Nasib metabolik non-oksidatif dari badan keton dan? OHB sebagai mediator pensinyalan). Mungkin juga badan keton yang diturunkan dari hepatosit dapat berfungsi sebagai sinyal dan / atau metabolit untuk jenis sel tetangga dalam asinus hati, termasuk sel bintang dan makrofag sel Kupffer. Sementara literatur terbatas yang tersedia menunjukkan bahwa makrofag tidak dapat mengoksidasi badan keton, ini hanya diukur dengan menggunakan metodologi klasik, dan hanya pada makrofag peritoneal (Newsholme et al., 1986; Newsholme et al., 1987), menunjukkan bahwa re- penilaian sesuai dengan ekspresi SCOT yang melimpah di makrofag yang diturunkan dari sumsum tulang (Youm et al., 2015).
Perubahan ketogenik hepatosit juga dapat bersifat sitoprotektif. Sementara mekanisme yang bermanfaat mungkin tidak bergantung pada ketogenesis itu sendiri, diet ketogenik rendah karbohidrat telah dikaitkan dengan perbaikan NAFLD (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar dan Crawford, 2012) . Pengamatan kami menunjukkan bahwa ketogenesis hepatosit dapat memberi umpan balik dan mengatur fluks siklus TCA, fluks anaplerotik, glukoneogenesis turunan fosfoenolpiruvat (Cotter et al., 2014), dan bahkan pergantian glikogen. Kerusakan ketogenik mengarahkan asetil-KoA untuk meningkatkan fluks TCA, yang di hati telah dikaitkan dengan peningkatan cedera yang dimediasi oleh ROS (Satapati et al., 2015; Satapati et al., 2012); memaksa pengalihan karbon menjadi spesies lipid yang disintesis de novo yang dapat membuktikan sitotoksik; dan mencegah oksidasi ulang NADH menjadi NAD + (Cotter et al., 2014) (Gbr. 4). Secara bersama-sama, percobaan masa depan diperlukan untuk mengatasi mekanisme di mana insufisiensi ketogenik relatif dapat menjadi maladaptif, berkontribusi pada hiperglikemia, memicu steatohepatitis, dan apakah mekanisme ini bekerja pada NAFLD / NASH manusia. Karena bukti epidemiologis menunjukkan gangguan ketogenesis selama perkembangan steatohepatitis (Embade et al., 2016; Marinou et al., 2011; M nnist et al., 2015; Pramfalk et al., 2015; Safaei et al., 2016) terapi yang meningkatkan ketogenesis hati terbukti bermanfaat (Degirolamo et al., 2016; Honda et al., 2016).
Badan Keton dan Gagal Jantung (HF)
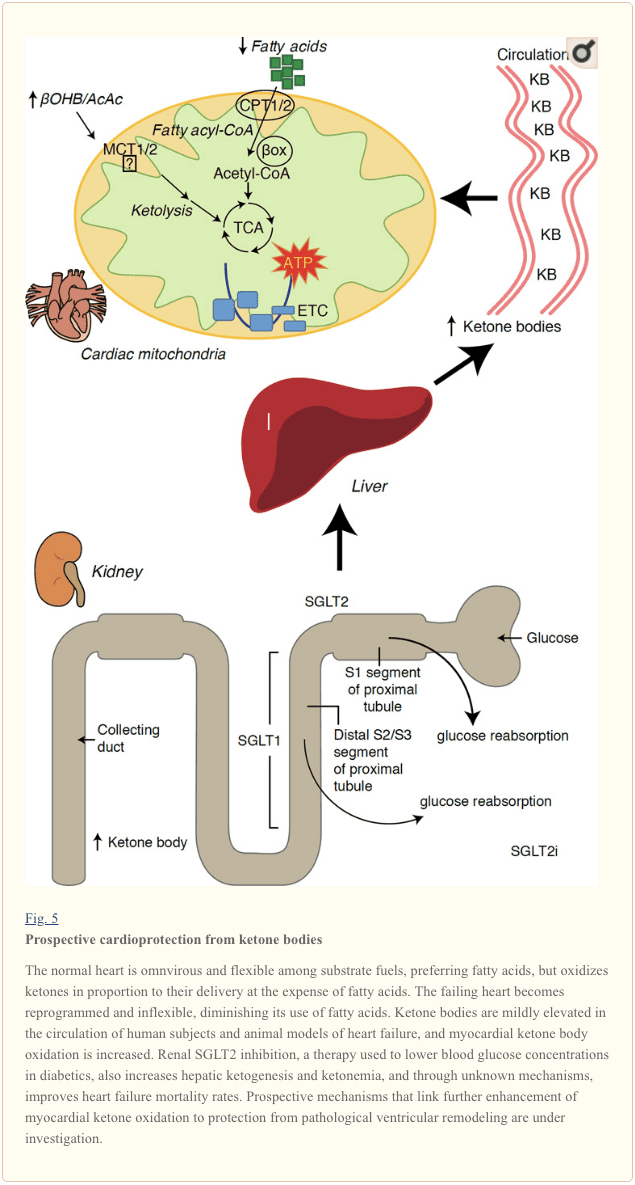
Dengan laju metabolisme melebihi 400 kkal/kg/hari, dan pergantian 6-35 kg ATP/hari, jantung merupakan organ dengan pengeluaran energi dan kebutuhan oksidatif tertinggi (Ashrafian et al., 2007; Wang et al., 2010b). Sebagian besar pergantian energi miokard berada di dalam mitokondria, dan 70% dari pasokan ini berasal dari FAO. Jantung bersifat omnivora dan fleksibel dalam kondisi normal, tetapi jantung yang mengalami remodeling patologis (misalnya karena hipertensi atau infark miokard) dan jantung diabetes masing-masing menjadi tidak fleksibel secara metabolik (Balasse dan Fery, 1989; BING, 1954; Fukao et al., 2004 ; Lopaschuk dkk., 2010; Taegtmeyer dkk., 1980; Taegtmeyer dkk., 2002; Young dkk., 2002). Memang, kelainan metabolisme bahan bakar jantung yang diprogram secara genetik pada model tikus memicu kardiomiopati (Carley et al., 2014; Neubauer, 2007). Dalam kondisi fisiologis, jantung normal mengoksidasi badan keton secara proporsional dengan pengirimannya, dengan mengorbankan asam lemak dan oksidasi glukosa, dan miokardium adalah konsumen badan keton tertinggi per satuan massa (BING, 1954; Crawford et al., 2009; GARLAND et al. ., 1962; Hasselbaink et al., 2003; Jeffrey et al., 1995; Pelletier et al., 2007; Tardif et al., 2001; Yan et al., 2009). Dibandingkan dengan oksidasi asam lemak, badan keton lebih efisien secara energi, menghasilkan lebih banyak energi yang tersedia untuk sintesis ATP per molekul oksigen yang diinvestasikan (rasio P/O) (Kashiwaya et al., 2010; Sato et al., 1995; Veech, 2004) . Oksidasi badan keton juga menghasilkan energi yang berpotensi lebih tinggi daripada FAO, menjaga ubikuinon teroksidasi, yang meningkatkan rentang redoks dalam rantai transpor elektron dan membuat lebih banyak energi tersedia untuk mensintesis ATP (Sato et al., 1995; Veech, 2004). Oksidasi badan keton juga dapat membatasi produksi ROS, dan dengan demikian stres oksidatif (Veech, 2004).
Studi intervensi dan observasi awal menunjukkan potensi peran penting dari badan keton di jantung. Dalam konteks cedera iskemia / reperfusi eksperimental, badan keton memberikan efek kardioprotektif potensial (Al-Zaid dkk., 2007; Wang et al., 2008), mungkin karena peningkatan kelimpahan mitokondria di jantung atau up-regulasi fosforilasi oksidatif krusial. mediator (Snorek et al., 2012; Zou et al., 2002). Studi terbaru menunjukkan bahwa pemanfaatan tubuh keton meningkat pada gagal jantung tikus (Aubert et al., 2016) dan manusia (Bedi et al., 2016), mendukung pengamatan sebelumnya pada manusia (BING, 1954; Fukao et al., 2000; Janardhan dkk., 2011; Longo dkk., 2004; Rudolph dan Schinz, 1973; Tildon dan Cornblath, 1972). Konsentrasi keton tubuh yang bersirkulasi meningkat pada pasien gagal jantung, dalam proporsi langsung terhadap tekanan pengisian, pengamatan yang mekanisme dan signifikansinya masih belum diketahui (Kupari et al., 1995; Lommi et al., 1996; Lommi dkk., 1997; Neely et al. ., 1972), tetapi tikus dengan defisiensi SCOT selektif dalam cardiomyocytes menunjukkan percepatan remodeling ventrikel yang dipercepat dan tanda tangan ROS sebagai respons terhadap cedera overload tekanan pembedahan yang diinduksi (Schugar et al., 2014).
Observasi terbaru yang menarik dalam terapi diabetes telah mengungkapkan hubungan potensial antara metabolisme keton miokard dan remodeling ventrikel patologis (Gambar 5). Penghambatan transporter tubular natrium / glukosa tubular natrium renal 2 (SGLT2i) meningkatkan sirkulasi konsentrasi tubuh keton pada manusia (Ferrannini dkk., 2016a; Inagaki et al., 2015) dan tikus (Suzuki et al., 2014) melalui peningkatan ketogenesis hati (Ferrannini dkk., 2014; Ferrannini dkk., 2016a; Katz dan Leiter, 2015; Mudaliar et al., 2015). Menariknya, setidaknya satu dari agen ini menurunkan rawat inap HF (misalnya, seperti yang diungkapkan oleh uji coba EMPA-REG OUTCOME), dan peningkatan mortalitas kardiovaskular (Fitchett et al., 2016; Sonesson dkk., 2016; Wu et al., 2016a ; Zinman dkk., 2015). Sementara mekanisme penggerak di balik hasil HF yang bermanfaat untuk menghubungkan SGLT2i tetap diperdebatkan secara aktif, manfaat kelangsungan hidup cenderung multifaktorial, secara prospektif termasuk ketosis tetapi juga efek bermanfaat pada berat badan, tekanan darah, glukosa dan kadar asam urat, kekakuan arteri, sistem saraf simpatik, osmotik diuresis / penurunan volume plasma, dan peningkatan hematokrit (Raz dan Cahn, 2016; Vallon dan Thomson, 2016). Secara bersama-sama, gagasan bahwa terapi meningkatkan ketonemia baik pada pasien HF, atau mereka yang berisiko tinggi untuk mengembangkan gagal jantung, tetap kontroversial tetapi berada di bawah penyelidikan aktif dalam pra-klinis dan studi klinis (Ferrannini et al., 2016b; Kolwicz et al., 2016, Lopaschuk dan Verma, 2016; Mudaliar et al., 2016; Taegtmeyer, 2016).
Badan Keton dalam Biologi Kanker
Hubungan antara badan keton dan kanker berkembang dengan cepat, tetapi studi pada kedua model hewan dan manusia telah menghasilkan kesimpulan yang beragam. Karena metabolisme keton bersifat dinamis dan responsif terhadap gizi, ia tertarik untuk mengejar koneksi biologis ke kanker karena potensi terapi nutrisi yang dipandu dengan presisi. Sel-sel kanker menjalani pemrograman ulang metabolik untuk menjaga proliferasi dan pertumbuhan sel yang cepat (DeNicola dan Cantley, 2015; Pavlova dan Thompson, 2016). Efek Warburg klasik dalam metabolisme sel kanker muncul dari peran dominan glikolisis dan fermentasi asam laktat untuk mentransfer energi dan mengkompensasi ketergantungan yang lebih rendah pada fosforilasi oksidatif dan respirasi mitokondria terbatas (De Feyter dkk., 2016; Grabacka et al., 2016; Kang et al., 2015; Poff dkk., 2014; Shukla et al., 2014). Glukosa karbon terutama diarahkan melalui glikolisis, jalur pentosa fosfat, dan lipogenesis, yang bersama-sama menyediakan intermediet yang diperlukan untuk ekspansi biomassa tumor (Grabacka et al., 2016; Shukla et al., 2014; Yoshii et al., 2015). Adaptasi sel kanker untuk deprivasi glukosa terjadi melalui kemampuan untuk mengeksploitasi sumber bahan bakar alternatif, termasuk asetat, glutamin, dan aspartat (Jaworski et al., 2016; Sullivan et al., 2015). Sebagai contoh, akses terbatas ke piruvat mengungkapkan kemampuan sel kanker untuk mengubah glutamin menjadi asetil-CoA oleh karboksilasi, mempertahankan baik kebutuhan energik dan anabolik (Yang et al., 2014). Adaptasi yang menarik dari sel kanker adalah pemanfaatan asetat sebagai bahan bakar (Comerford dkk., 2014; Jaworski dkk., 2016; Mashimo dkk., 2014; Wright dan Simone, 2016; Yoshii et al., 2015). Asetat juga merupakan substrat untuk lipogenesis, yang sangat penting untuk proliferasi sel tumor, dan keuntungan dari saluran lipogenik ini terkait dengan kelangsungan hidup pasien yang lebih pendek dan beban tumor yang lebih besar (Comerford dkk., 2014; Mashimo dkk., 2014; Yoshii et al. ., 2015).
Sel non-kanker dengan mudah mengalihkan sumber energinya dari glukosa ke badan keton selama kekurangan glukosa. Plastisitas ini mungkin lebih bervariasi di antara jenis sel kanker, tetapi tumor otak yang ditanamkan secara in vivo teroksidasi [2,4-13C2] -? OHB ke tingkat yang sama seperti jaringan otak di sekitarnya (De Feyter et al., 2016). Model Reverse Warburg effect atau two compartment tumor metabolism model berhipotesis bahwa sel kanker menginduksi? Produksi OHB dalam fibroblas yang berdekatan, melengkapi kebutuhan energi sel tumor (Bonuccelli et al., 2010; Martinez-Outschoorn et al., 2012) . Di hati, pergeseran hepatosit dari ketogenesis ke oksidasi keton pada sel karsinoma hepatoseluler (hepatoma) konsisten dengan aktivasi aktivitas BDH1 dan SCOT yang diamati pada dua baris sel hepatoma (Zhang et al., 1989). Memang, sel hepatoma mengekspresikan OXCT1 dan BDH1 dan mengoksidasi keton, tetapi hanya ketika serum kelaparan (Huang et al., 2016). Sebagai alternatif, ketogenesis sel tumor juga telah diusulkan. Pergeseran dinamis dalam ekspresi gen ketogenik dipamerkan selama transformasi kanker epitel kolon, jenis sel yang biasanya mengekspresikan HMGCS2, dan laporan terbaru menunjukkan bahwa HMGCS2 mungkin merupakan penanda prognostik prognosis yang buruk pada karsinoma sel kolorektal dan skuamosa (Camarero et al., 2006; Chen et al., 2016). Apakah asosiasi ini memerlukan atau melibatkan ketogenesis, atau fungsi sambilan dari HMGCS2, masih harus ditentukan. Sebaliknya, produksi OHB yang jelas oleh sel melanoma dan glioblastoma, dirangsang oleh PPAR? agonis fenofibrate, dikaitkan dengan penghentian pertumbuhan (Grabacka et al., 2016). Studi lebih lanjut diperlukan untuk mengkarakterisasi peran ekspresi HMGCS2 / SCOT, ketogenesis, dan oksidasi keton dalam sel kanker.
Di luar bidang metabolisme bahan bakar, keton baru-baru ini terlibat dalam biologi sel kanker melalui mekanisme pensinyalan. Analisis melanoma BRAF-V600E + menunjukkan induksi HMGCL yang bergantung pada OCT1 dengan cara yang bergantung pada BRAF onkogenik (Kang et al., 2015). Augmentasi HMGCL berkorelasi dengan konsentrasi AcAc seluler yang lebih tinggi, yang pada gilirannya meningkatkan interaksi BRAFV600E-MEK1, memperkuat sinyal MEK-ERK dalam putaran umpan maju yang mendorong proliferasi dan pertumbuhan sel tumor. Pengamatan ini menimbulkan pertanyaan menarik tentang ketogenesis ekstrahepatik prospektif yang kemudian mendukung mekanisme pensinyalan (lihat juga? OHB sebagai mediator pensinyalan dan Kontroversi dalam ketogenesis ekstrahepatik). Penting juga untuk mempertimbangkan efek independen AcAc, d-? OHB, dan l-? OHB pada metabolisme kanker, dan ketika mempertimbangkan HMGCL, katabolisme leusin juga dapat terganggu.
Efek diet ketogenik (juga lihat Penggunaan terapi diet ketogenik dan badan keton eksogen) pada model hewan kanker bervariasi (De Feyter et al., 2016; Klement et al., 2016; Meidenbauer et al., 2015; Poff et al. ., 2014; Seyfried et al., 2011; Shukla et al., 2014). Sementara hubungan epidemiologi antara obesitas, kanker, dan diet ketogenik diperdebatkan (Liskiewicz et al., 2016; Wright dan Simone, 2016), sebuah meta-analisis menggunakan diet ketogenik pada model hewan dan dalam penelitian pada manusia menunjukkan dampak yang bermanfaat pada kelangsungan hidup, dengan manfaat prospektif terkait dengan besarnya ketosis, waktu inisiasi diet, dan lokasi tumor (Klement et al., 2016; Woolf et al., 2016). Pengobatan sel kanker pankreas dengan badan keton (d-?OHB atau AcAc) menghambat pertumbuhan, proliferasi dan glikolisis, dan diet ketogenik (81% kkal lemak, 18% protein, 1% karbohidrat) mengurangi berat tumor in vivo, glikemia, dan peningkatan otot dan berat badan pada hewan dengan kanker implan (Shukla et al., 2014). Hasil serupa diamati menggunakan model sel glioblastoma metastatik pada tikus yang menerima suplementasi keton dalam makanan (Poff et al., 2014). Sebaliknya, diet ketogenik (91% kkal lemak, 9% protein) meningkatkan konsentrasi OHB yang bersirkulasi dan mengurangi glikemia, tetapi tidak berdampak pada volume tumor atau durasi kelangsungan hidup pada tikus yang mengandung glioma (De Feyter et al., 2016). Indeks keton glukosa telah diusulkan sebagai indikator klinis yang meningkatkan manajemen metabolisme terapi kanker otak yang diinduksi diet ketogenik pada manusia dan tikus (Meidenbauer et al., 2015). Secara bersama-sama, peran metabolisme tubuh keton dan badan keton dalam biologi kanker sangat menggoda karena masing-masing memiliki pilihan terapi yang dapat dikendalikan, tetapi aspek fundamental masih harus dijelaskan, dengan pengaruh yang jelas muncul dari matriks variabel, termasuk (i) perbedaan antara keton eksogen tubuh versus diet ketogenik, (ii) jenis sel kanker, polimorfisme genomik, derajat, dan stadium; dan (iii) waktu dan durasi paparan keadaan ketotik.

Ketogenesis dibuat oleh tubuh keton melalui pemecahan asam lemak dan asam amino ketogenik. Proses biokimia ini memberikan energi ke berbagai organ, khususnya otak, dalam keadaan puasa sebagai respons terhadap tidak tersedianya glukosa darah. Badan keton terutama diproduksi di mitokondria sel hati. Sementara sel-sel lain mampu melakukan ketogenesis, sel-sel ini tidak seefektif melakukannya seperti sel-sel hati. Karena ketogenesis terjadi di mitokondria, prosesnya diatur secara independen. Dr Alex Jimenez DC, CCST Insight
Aplikasi Terapi Ketogenic Diet dan Exogenous Ketone Bodies
Penerapan diet ketogenik dan badan keton sebagai alat terapi juga muncul dalam konteks non-kanker termasuk obesitas dan NAFLD/NASH (Browning et al., 2011; Foster et al., 2010; Schugar dan Crawford, 2012); gagal jantung (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); penyakit neurologis dan neurodegeneratif (Martin et al., 2016; McNally dan Hartman, 2012; Rho, 2015; Rogawski et al., 2016; Yang dan Cheng, 2010; Yao et al., 2011); kesalahan metabolisme bawaan (Scholl-B�rgi et al, 2015); dan kinerja olahraga (Cox et al., 2016). Kemanjuran diet ketogenik sangat dihargai dalam terapi kejang epilepsi, terutama pada pasien yang resistan terhadap obat. Sebagian besar penelitian telah mengevaluasi diet ketogenik pada pasien anak, dan mengungkapkan hingga 50% pengurangan frekuensi kejang setelah 3 bulan, dengan peningkatan efektivitas pada sindrom tertentu (Wu et al., 2016b). Pengalaman lebih terbatas pada epilepsi dewasa, tetapi penurunan serupa terbukti, dengan respon yang lebih baik pada pasien epilepsi umum simtomatik (Nei et al., 2014). Mekanisme antikonvulsan yang mendasari masih belum jelas, meskipun hipotesis yang didalilkan meliputi pengurangan penggunaan glukosa/glikolisis, transpor glutamat yang diprogram ulang, dampak tidak langsung pada saluran kalium yang sensitif terhadap ATP atau reseptor adenosin A1, perubahan ekspresi isoform saluran natrium, atau efek pada hormon yang bersirkulasi termasuk leptin. Lambrechts et al., 2016; Lin et al., 2017; Lutas dan Yellen, 2013). Masih belum jelas apakah efek antikonvulsan terutama disebabkan oleh badan keton, atau karena konsekuensi metabolik kaskade dari diet rendah karbohidrat. Meskipun demikian, ester keton (lihat di bawah) tampaknya meningkatkan ambang kejang pada model hewan dari kejang yang diprovokasi (Ciarlone et al., 2016; D'Agostino et al., 2013; Viggiano et al., 2015).
Atkins-gaya dan ketogenik, diet rendah karbohidrat sering dianggap tidak menyenangkan, dan dapat menyebabkan konstipasi, hiperurisemia, hipokalsemia, hipomagnesemia, menyebabkan nefrolitiasis, ketoasidosis, menyebabkan hiperglikemia, dan meningkatkan kolesterol beredar dan konsentrasi asam lemak bebas (Bisschop et al., 2001 ; Kossoff dan Hartman, 2012; Kwiterovich dkk., 2003; Suzuki et al., 2002). Untuk alasan ini, kepatuhan jangka panjang menimbulkan tantangan. Penelitian pada hewan pengerat umumnya menggunakan distribusi makronutrien yang khas (lemak 94% kkal, karbohidrat 1% kkal, protein 5% kkal, Bio-Serv F3666), yang memicu ketosis yang kuat. Namun, meningkatkan kandungan protein, bahkan hingga 10% kkal secara substansial mengurangi ketosis, dan 5% kcal pembatasan protein menganugerahkan efek metabolik dan fisiologis yang membingungkan. Formulasi diet ini juga kolin habis, variabel lain yang mempengaruhi kerentanan terhadap cedera hati, dan bahkan ketogenesis (Garbow dkk., 2011; Jornayvaz dkk., 2010; Kennedy et al., 2007; Pissios et al., 2013; Schugar et al., 2013). Efek konsumsi jangka panjang diet ketogenik pada tikus tetap tidak jelas, tetapi penelitian terbaru pada tikus menunjukkan kelangsungan hidup normal dan tidak adanya penanda cedera hati pada tikus pada diet ketogenik selama masa hidup mereka, meskipun metabolisme asam amino, pengeluaran energi, dan pensinyalan insulin secara nyata diprogram ulang (Douris et al., 2015).
Mekanisme meningkatkan ketosis melalui mekanisme alternatif untuk diet ketogenik termasuk penggunaan prekursor keton tubuh ingestible. Pemberian badan keton eksogen dapat menciptakan keadaan fisiologis yang unik yang tidak ditemui dalam fisiologi normal, karena glukosa dan konsentrasi insulin yang bersirkulasi relatif normal, sementara sel mungkin menghemat ambilan glukosa dan pemanfaatannya. Badan keton sendiri memiliki waktu paruh yang pendek, dan konsumsi atau infus garam natrium-OHB untuk mencapai ketosis terapeutik memicu beban natrium yang tidak diinginkan. R / S-1,3-butanediol adalah dialalkohol tidak beracun yang mudah teroksidasi di hati untuk menghasilkan d / l-? OHB (Desrochers et al., 1992). Dalam konteks eksperimental yang berbeda, dosis ini telah diberikan setiap hari kepada tikus atau tikus selama tujuh minggu, menghasilkan konsentrasi OHB yang bersirkulasi hingga 5 mM dalam 2 jam pemberian, yang stabil untuk setidaknya 3 jam tambahan (D ' Agostino et al., 2013). Penekanan parsial asupan makanan telah diamati pada hewan pengerat yang diberikan R / S-1,3-butanediol (Carpenter dan Grossman, 1983). Selain itu, tiga keton ester (KEs) yang berbeda secara kimiawi, (i) monoester dari R-1,3-butanediol dan d-? OHB (R-3-hidroksibutil R-? OHB); (ii) gliseril-tris-? OHB; dan (iii) R, S-1,3-butanediol acetoacetate diester, juga telah dipelajari secara ekstensif (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a; Desrochers et al. ., 1995b; Kashiwaya et al., 2010). Keuntungan inheren dari yang pertama adalah bahwa 2 mol fisiologis d-? OHB diproduksi per mol KE, mengikuti hidrolisis esterase di usus atau hati. Keamanan, farmakokinetik, dan toleransi telah dipelajari secara ekstensif pada manusia yang menelan R-3-hidroksibutil R-? OHB, pada dosis hingga 714 mg / kg, menghasilkan konsentrasi d-? OHB yang bersirkulasi hingga 6 mM (Clarke et al., 2012a; Cox dkk., 2016; Kemper dkk., 2015; Shivva dkk., 2016). Pada hewan pengerat, KE ini menurunkan asupan kalori dan kolesterol total plasma, menstimulasi jaringan adiposa coklat, dan meningkatkan resistensi insulin (Kashiwaya dkk., 2010; Kemper dkk., 2015; Veech, 2013). Temuan terbaru menunjukkan bahwa selama latihan pada atlet terlatih, konsumsi R-3-hydroxybutyl R-? OHB menurunkan glikolisis otot rangka dan konsentrasi laktat plasma, peningkatan oksidasi triasilgliserol intramuskular, dan kandungan glikogen otot yang diawetkan, bahkan ketika karbohidrat yang tertelan bersama merangsang sekresi insulin ( Cox dkk., 2016). Pengembangan lebih lanjut dari hasil yang menarik ini diperlukan, karena peningkatan dalam kinerja latihan daya tahan sebagian besar didorong oleh respon yang kuat terhadap KE pada subjek 2 / 8. Meskipun demikian, hasil ini mendukung studi klasik yang menunjukkan preferensi untuk oksidasi keton atas substrat lain (GARLAND dkk., 1962; Hasselbaink et al., 2003; Stanley dkk., 2003; Valente-Silva et al., 2015), termasuk selama latihan, dan bahwa atlet terlatih mungkin lebih prima untuk memanfaatkan keton (Johnson et al., 1969a; Johnson dan Walton, 1972; Winder dkk., 1974; Winder dkk., 1975). Akhirnya, mekanisme yang mungkin mendukung peningkatan kinerja latihan setelah asupan kalori yang sama (terdistribusi secara diferensial di antara macronutrients) dan tingkat konsumsi oksigen yang sama tetap harus ditentukan.
Perspektif Masa Depan
Setelah sebagian besar dicap sebagai jalur luapan yang mampu mengumpulkan emisi beracun dari pembakaran lemak dalam keadaan terbatas karbohidrat (paradigma 'ketotoksik'), pengamatan baru-baru ini mendukung gagasan bahwa metabolisme tubuh keton memiliki peran yang bermanfaat bahkan dalam keadaan sarat karbohidrat, membuka 'ketohormetik'. � hipotesis. Sementara pendekatan nutrisi dan farmakologis yang mudah untuk memanipulasi metabolisme keton menjadikannya target terapi yang menarik, eksperimen yang dilakukan secara agresif tetapi bijaksana tetap ada di laboratorium penelitian dasar dan translasi. Kebutuhan yang tidak terpenuhi telah muncul dalam domain mendefinisikan peran meningkatkan metabolisme keton pada gagal jantung, obesitas, NAFLD/NASH, diabetes tipe 2, dan kanker. Cakupan dan dampak peran pensinyalan 'non-kanonik' dari badan keton, termasuk regulasi PTM yang kemungkinan memberi umpan balik dan maju ke jalur metabolisme dan pensinyalan, memerlukan eksplorasi lebih dalam. Akhirnya, ketogenesis ekstrahepatik dapat membuka mekanisme pensinyalan parakrin dan autokrin yang menarik dan peluang untuk mempengaruhi metabolisme bersama dalam sistem saraf dan tumor untuk mencapai tujuan terapeutik.
Ucapan Terima Kasih
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
Catatan kaki
Kesimpulannya, badan keton dibuat oleh hati untuk digunakan sebagai sumber energi ketika tidak ada cukup glukosa yang tersedia di tubuh manusia. Ketogenesis terjadi ketika kadar glukosa dalam darah rendah, terutama setelah simpanan karbohidrat seluler habis. Tujuan artikel di atas adalah untuk membahas peran multidimensi badan keton dalam metabolisme bahan bakar, pensinyalan, dan terapi. Cakupan informasi kami terbatas pada masalah chiropraktik dan kesehatan tulang belakang. Untuk membahas pokok bahasan ini, jangan ragu untuk bertanya kepada Dr. Jimenez atau hubungi kami di 915-850-0900 .
Diundangkan oleh Dr. Alex Jimenez
Diacu dari: Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

Topik Tambahan Diskusi: Acute Back Pain
Nyeri punggung adalah salah satu penyebab paling umum dari kecacatan dan hari-hari yang terlewat di tempat kerja di seluruh dunia. Nyeri punggung dikaitkan dengan alasan paling umum kedua untuk kunjungan kantor dokter, kalah jumlah hanya oleh infeksi saluran pernapasan atas. Sekitar 80 persen populasi akan mengalami sakit punggung setidaknya sekali sepanjang hidup mereka. Tulang belakang adalah struktur kompleks yang terdiri dari tulang, persendian, ligamen, dan otot, di antara jaringan lunak lainnya. Cedera dan / atau kondisi yang semakin parah, seperti cakram hernia, pada akhirnya dapat menimbulkan gejala nyeri punggung. Cedera olahraga atau cedera kecelakaan mobil sering kali menjadi penyebab paling sering dari nyeri punggung, namun terkadang gerakan yang paling sederhana bisa menimbulkan rasa sakit. Untungnya, pilihan pengobatan alternatif, seperti perawatan chiropractic, dapat membantu meringankan sakit punggung melalui penggunaan penyesuaian tulang belakang dan manipulasi manual, yang pada akhirnya meningkatkan pereda nyeri. �

EXTRA EXTRA | TOPIK PENTING: Direkomendasikan El Paso, TX Chiropractor
***