1. SIAPA. SIAPA | Kegemukan dan obesitas. www.who.int/gho/ncd/
risk_factors/overweight/en/index.html. Diakses pada 29 Januari 2015.
2. Visscher PM, Brown MA, McCarthy MI, Yang J. Lima tahun penemuan GWAS.
Apakah J Hum Genet. 2012;90:7�24.
3. Locke AE, Kahali B, Berndt SI, Justice AE, Pers TH, Day FR, dkk. Genetik
studi indeks massa tubuh menghasilkan wawasan baru untuk biologi obesitas. Alam.
2015; 518: 197 206.
4. Ling C, Del Guerra S, Lupi R, R�nn T, Granhall C, Luthman H, dkk.
Regulasi epigenetik PPARGC1A di pulau diabetes tipe 2 manusia dan
efek pada sekresi insulin. diabetes. 2008;51:615�22.
5. Van Dijk SJ, Molloy PL, Varinli H, Morrison JL, Muhlhausler BS. Epigenetik
dan obesitas manusia. Int J Obes (London). 2015;39:85�97.
6. Teh AL, Pan H, Chen L, Ong ML, Dogra S, Wong J, dkk. Efek dari
genotipe dan lingkungan dalam rahim pada variasi antarindividu pada neonatus
metilom DNA. Res. Genom 2014;24:1064�74.
7. Olsson AH, Volkov P, Bacos K, Dayeh T, Hall E, Nilsson EA, dkk. seluruh genom
hubungan antara pengaruh variasi genetik dan epigenetik
ekspresi mRNA dan sekresi insulin di pulau pankreas manusia. PLoS
gen. 2014;10:e1004735.
8. Grundberg E, Meduri E, Sandling JK, Hedman AK, Keildson S, Buil A, dkk.
Analisis global variasi metilasi DNA dalam jaringan adiposa dari kembar
mengungkapkan tautan ke varian terkait penyakit dalam elemen regulasi distal.
Apakah J Hum Genet. 2013;93:876�90.
9. Ronn T, Volkov P, Gillberg L, Kokosar M, Perfilyev A, Jacobsen AL, dkk.
Dampak usia, BMI, dan kadar HbA1c pada DNA seluruh genom
metilasi dan pola ekspresi mRNA dalam jaringan adiposa manusia
dan identifikasi biomarker epigenetik dalam darah. Hum Mol Genet.
2015; 24: 3792 813.
10. Waterland RA, Michels KB. Epigenetik epidemiologi perkembangan
hipotesis asal. Annu Rev Nutr. 2007;27:363�88.
11. McMillen IC, Rattanatray L, Duffield JA, Morrison JL, MacLaughlin SM, Gentili
S, dkk. Asal-usul awal obesitas kemudian: jalur dan mekanisme. Adv
Exp Medi Biol. 2009;646:71�81.
12. Ravelli A, van der Meulen J, Michels R, Osmond C, Barker D, Hales C, dkk.
Toleransi glukosa pada orang dewasa setelah paparan prenatal terhadap kelaparan. Lanset.
1998; 351: 173 7.
13. McMillen IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
Morrison JL. Asal-usul perkembangan kesehatan dan penyakit orang dewasa: peran
nutrisi perikonsepsi dan janin. Basic Clin Pharmacol Toxicol.
2008; 102: 82 9.
14. Zhang S, Rattanatray L, McMillen IC, Suter CM, Morrison JL. Perikonsepsi
nutrisi dan program awal kehidupan obesitas atau kesulitan. Prog
Biofisis Mol Biol. 2011;106:307�14.
15. Bouret S, Levin BE, Ozanne SE. Interaksi gen-lingkungan mengendalikan
energi dan homeostasis glukosa dan asal-usul perkembangan obesitas.
Physiol Rev.2015;95:47�82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, Ronis MJ, Badger TM, dkk.
Obesitas ibu meningkatkan diferensiasi jaringan adiposa putih dan mengubah
metilasi DNA skala genom pada keturunan tikus jantan. Endokrinologi.
2013; 154: 4113 25.
17. Gluckman PD, Lillycrop KA, Vickers MH, Pleasant AB, Phillips ES, Beedle AS,
dkk. Plastisitas metabolik selama perkembangan mamalia bersifat terarah
tergantung pada status gizi awal. Proc Natl Acad Sci US A.
2007; 104: 12796 800.
18. Godfrey KM, Sheppard A, Gluckman PD, Lillycrop KA, Burdge GC, McLean C,
dkk. Metilasi promotor gen epigenetik saat lahir dikaitkan dengan
adipositas anak di kemudian hari. Diabetes. 2011;60:1528�34.
19. McMillen IC, Adam CL, Muhlhausler BS. Asal-usul awal obesitas:
memprogram sistem pengaturan nafsu makan. J Fisiol. 2005;565(Pt 1):9�17.
20. Begum G, Stevens A, Smith EB, Connor K, Challis JR, Bloomfield F, dkk.
Perubahan epigenetik pada jalur pengatur energi hipotalamus janin
terkait dengan kekurangan gizi ibu dan kembar. FASEB J.
2012; 26: 1694 703.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY, dkk. Obesitas ibu
dan diabetes dapat menyebabkan perubahan metilasi DNA pada spermatozoa
keturunan pada tikus. Reprod Biol Endokrinol. 2014;12:29.
22. Jousse C, Parry L, Lambert-Langlais S, Maurin AC, Averous J, Bruhat A, dkk.
Kekurangan gizi perinatal mempengaruhi metilasi dan ekspresi leptin
gen pada orang dewasa: implikasi untuk pemahaman sindrom metabolik.
FASEB J.2011;25:3271�8.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F, dkk.
Diet ibu selama kehamilan menginduksi ekspresi gen dan DNA
perubahan metilasi pada jaringan janin pada domba. Gen depan. 2013;4:49.
24. Li CC, PE Muda, Maloney CA, Eaton SA, Cowley MJ, Buckland ME, dkk.
Obesitas dan diabetes pada ibu menginduksi defek metabolik laten dan
perubahan epigenetik luas pada tikus isogenik. Epigenetik. 2013;8:602�11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Protein makanan
pembatasan menginduksi tikus hamil dan suplementasi asam folat mencegah
modifikasi epigenetik ekspresi gen hati pada keturunannya. J Nutr.
2005; 135: 1382 6.
26. Radford EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaitis E, dkk. Dalam kandungan
efek. Kekurangan gizi dalam rahim mengganggu metilome sperma dewasa
dan metabolisme antargenerasi. Sains. 2014;345(80):1255903.
27. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R, dkk.
Epigenomik: paparan diet tinggi lemak ibu dalam rahim mengganggu
ekspresi gen sirkadian perifer pada primata bukan manusia. FASEB J.
2011; 25: 714 26.
28. Suter MA, Ma J, Vuguin PM, Hartil K, Fiallo A, Harris RA, dkk. Dalam kandungan
paparan diet tinggi lemak ibu mengubah kode histon epigenetik di a
model murine. Am J Obs Ginekolog. 2014;210:463 e1�463 e11.
29. Tosh DN, Fu Q, Callaway CW, McKnight RA, McMillen IC, Ross MG, dkk.
Epigenetik obesitas terprogram: perubahan IUGR hati tikus IGF1
ekspresi mRNA dan struktur histone pada postnatal yang cepat vs. tertunda
pertumbuhan mengejar. Am J Physiol Gastrointest Liver Physiol.
2010;299:G1023�9.
30. Sandovici I, Smith NH, Nitert MD, Ackers-Johnson M, Uribe-Lewis S, Ito Y,
dkk. Diet ibu dan penuaan mengubah kontrol epigenetik dari promotor
interaksi pada gen Hnf4a di pulau pankreas tikus. Proc Natl
Acad Sci US A. 2011;108:5449�54.
31. Braunschweig M, Jagannathan V, Gutzwiller A, Bee G. Investigasi tentang
respons epigenetik transgenerasional di garis jantan pada babi F2. PLoS
Satu. 2012;7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R, dkk. dari pihak ayah
menginduksi pemrograman ulang lingkungan transgenerasional dari metabolisme
ekspresi gen pada mamalia. Sel. 2010;143:1084�96.
33. Ost A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M, dkk. Pola makan ayah
mendefinisikan keadaan kromatin keturunan dan obesitas antargenerasi. Sel.
2014; 159: 1352 64.
34. Mart�nez D, Pentinat T, Rib� S, Daviaud C, Bloks VW, Cebri� J, dkk. Dalam kandungan
kekurangan gizi pada tikus jantan memprogram metabolisme lipid hati pada generasi kedua
keturunan yang melibatkan metilasi DNA Lxra yang diubah. Metab Sel.
2014; 19: 941 51.
35. Wei Y, Yang CR, Wei YP, Zhao ZA, Hou Y, Schatten H, dkk. dari pihak ayah
pewarisan transgenerasional yang diinduksi dari kerentanan terhadap diabetes
mamalia. Proc Natl Acad Sci US A. 2014;111:1873�8.
36. Grossniklaus U, Kelly WG, Kelly B, Ferguson-Smith AC, Pembrey M, Lindquist
S. Warisan epigenetik transgenerasi: seberapa penting itu? Nat Rev
gen. 2013;14:228�35.
37. Pembrey M, Saffery R, Bygren LO. Tanggapan transgenerasi manusia terhadap
pengalaman awal kehidupan: dampak potensial pada perkembangan, kesehatan dan
penelitian biomedis. J Med Genet. 2014;51:563�72.
38. Wolff GL, Kodell RL, Moore SR, Cooney CA. Epigenetik dan metil ibu
suplemen mempengaruhi ekspresi gen agouti pada tikus Avy/a. FASEB J.
1998; 12: 949 57.
39. Jirtle RL, Skinner MK. Epigenomik lingkungan dan kerentanan penyakit.
Nat Rev Genet. 2007;8:253�62.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Warisan epigenetik di
lokus agouti pada tikus. Nat Gent. 1999;23:314�8.
41. Cropley JE, Suter CM, Beckman KB, Martin DI. Epigenetik garis kuman
modifikasi alel A vy murine dengan suplementasi nutrisi. proses
Natl Acad Sci US A. 2006;103:17308�12.
42. Hoile SP, Lillycrop KA, Thomas NA, Hanson MA, Burdge GC. Protein makanan
pembatasan selama kehamilan F0 pada tikus menginduksi perubahan transgenerasi dalam
transkriptom hati pada keturunan perempuan. PLoS Satu. 2011;6, e21668.
43. Multhaup ML, Seldin MM, Jaffe AE, Lei X, Kirchner H, Mondal P, dkk. manusia tikus
analisis epigenetik eksperimental membuka kedok target diet dan
tanggung jawab genetik untuk fenotipe diabetes. Metab Sel. 2015;21:138�49.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I, dkk.
Rekomendasi untuk desain dan analisis epigenome-wide
studi asosiasi. Metode Nat. 2013;10:949�55.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, R�nn T, Ling C. Identifikasi
CpG-SNPs terkait dengan diabetes tipe 2 dan metilasi DNA diferensial
di pulau pankreas manusia. diabetes. 2013;56:1036�46.
46. Relton CL, Davey Smith G. Pengacakan Mendel epigenetik dua langkah: a
strategi untuk menetapkan peran kausal dari proses epigenetik di jalur
untuk penyakit. Int J Epidemiol. 2012;41:161�76.
47. Liu Y, Aryee MJ, Padyukov L, Fallin MD, Hesselberg E, Runarsson A, dkk.
Data asosiasi epigenom-lebar berimplikasi metilasi DNA sebagai
perantara risiko genetik pada rheumatoid arthritis. Nat Bioteknologi.
2013; 31: 142 7.
48. Yuan W, Xia Y, Bell CG, Namun I, Ferreira T, Ward KJ, dkk. terintegrasi
analisis epigenomik untuk lokus kerentanan diabetes tipe 2 di monozigot
saudara kembar. Komunitas Nat. 2014;5:5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, Hall E, Nilsson E, dkk. Dampak dari sebuah
intervensi latihan pada metilasi DNA pada otot rangka dari tingkat pertama
kerabat pasien dengan diabetes tipe 2. Diabetes. 2012;61:3322�32.
50. Gagnon F, A�ssi D, Carri� A, Morange PE, Tr�gou�t DA. Validasi yang kuat dari
hubungan tingkat metilasi di lokus CPT1A dengan tingkat plasma lipid.
J Lipid Res. 2014;55:1189�91.
51. Demerath EW, Guan W, Grove ML, Aslibekyan S, Mendelson M, Zhou YH,
dkk. Studi asosiasi epigenome-wide (EWAS) dari BMI, perubahan BMI, dan
lingkar pinggang pada orang dewasa Afrika-Amerika mengidentifikasi banyak yang direplikasi
lokus. Hum Mol Genet. 2015:ddv161�.
52. Dick KJ, Nelson CP, Tsaprouni L, Sandling JK, A�ssi D, Wahl S, dkk. DNA
metilasi dan indeks massa tubuh: analisis genom-lebar. Lanset.
2014; 6736: 1 9.
53. Su S, Zhu H, Xu X, Wang X, Dong Y, Kapuku G, dkk. metilasi DNA dari
gen LY86 dikaitkan dengan obesitas, resistensi insulin, dan
peradangan. Twin Res Hum Gen. 2014;17:183�91.
54. Clarke-Harris R, Wilkin TJ, Hosking J, Pinkney J, Jeffery AN, Metcalf BS, dkk.
PGC1? metilasi promotor dalam darah pada 5-7 tahun memprediksi adipositas dari
9 hingga 14 tahun (EarlyBird 50). Diabetes. 2014;63:2528�37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L, dkk.
Metilasi DNA promotor gen ADRB3 dalam darah dan adiposa visceral
jaringan dikaitkan dengan gangguan metabolisme pada pria. Epigenomik.
2014; 6: 33 43.
56. Agha G, Houseman EA, Kelsey KT, Eaton CB, Buka SL, Loucks EB. Adipositas adalah
terkait dengan profil metilasi DNA dalam jaringan adiposa. Int J Epidemiol.
2014: 1 11.
57. Irvin MR, Zhi D, Joehanes R, Mendelson M, Aslibekyan S, Claas SA, dkk.
Studi asosiasi epigenom-lebar lipid darah puasa dalam genetika
obat penurun lipid dan studi jaringan diet. Sirkulasi. 2014;130:565�72.
58. Frazier-Wood AC, Aslibekyan S, Absher DM, Hopkins PN, Sha J, Tsai MY, dkk.
Metilasi di lokus CPT1A dikaitkan dengan subfraksi lipoprotein
profil. J Lipid Res. 2014;55:1324�30.
59. Pfeifferm L, Wahl S, Pilling LC, Reischl E, Sandling JK, Kunze S, dkk. DNA
metilasi gen terkait lipid mempengaruhi kadar lipid darah. Circ Cardiovasc
gen. 2015.
60. Petersen AK, Zeilinger S, Kastenm�ller G, R�misch-Margl W, Brugger M, Peters
A, dkk. Epigenetika bertemu dengan metabolomik: asosiasi luas epigenom
studi dengan ciri-ciri metabolisme serum darah. Hum Mol Genet. 2014;23:534�45.
61. Hidalgo B, Irvin MR, Sha J, Zhi D, Aslibekyan S, Absher D, dkk. Epigenomewide
studi asosiasi ukuran puasa glukosa, insulin, dan HOMA-IR
dalam genetika obat penurun lipid dan studi jaringan diet. Diabetes.
2014; 63: 801 7.
62. Dayeh T, Volkov P, Sal� S, Hall E, Nilsson E, Olsson AH, dkk. Seluas genom
Analisis metilasi DNA pulau pankreas manusia dari diabetes tipe 2
dan donor non-diabetes mengidentifikasi gen kandidat yang mempengaruhi insulin
sekresi. Gen PLoS. 2014;10, e1004160.
63. Nilsson E, Jansson PA, Perfilyev A, Volkov P, Pedersen M, Svensson MK, dkk.
Metilasi DNA yang berubah dan ekspresi diferensial gen yang mempengaruhi
metabolisme dan peradangan pada jaringan adiposa dari subjek dengan tipe 2
diabetes. Diabetes. 2014;63:2962�76.
64. Benton MC, Johnstone A, Eccles D, Harmon B, Hayes MT, Lea RA, dkk. Analisis metilasi DNA dalam jaringan adiposa manusia mengungkapkan modifikasi diferensial gen obesitas sebelum dan sesudah bypass lambung dan berat badan
kehilangan. gen. 2015;16:1�21.
65. Bateson P, Gluckman P. Plastisitas dan ketahanan dalam pengembangan dan
evolusi. Int J Epidemiol. 2012;41:219�23.
66. Feinberg AP, Irizarry RA, Feinberg AP, Irizarry RA. Evolusi dalam kesehatan dan
kolokium Sackler obat: variasi epigenetik stokastik sebagai pendorong
kekuatan perkembangan, adaptasi evolusioner, dan penyakit. Proc Natl Acad
Sci US A. 2010;107(Suppl):1757�64.
67. Martino D, Loke YJ, Gordon L, Ollikainen M, Cruickshank MN, Saffery R, dkk.
Analisis metilasi DNA skala genom pada anak kembar sejak lahir
hingga usia 18 bulan menunjukkan perubahan epigenetik yang cepat pada awal kehidupan dan spesifik pasangan
efek ketidaksesuaian. Biol genom. 2013;14:R42.
68. Tobi EW, Goeman JJ, Monajemi R, Gu H, Putter H, Zhang Y, dkk. DNA
tanda tangan metilasi menghubungkan paparan kelaparan prenatal dengan pertumbuhan dan
metabolisme. Komunitas Nat. 2014;5:5592.
69. Dominguez-Salas P, Moore SE, Baker MS, Bergen AW, Cox SE, Dyer RA, dkk.
Nutrisi ibu pada saat pembuahan memodulasi metilasi DNA manusia
epialel metastabil. Komunitas Nat. 2014;5:3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L, dkk.
Dampak pada pola metilasi keturunan diabetes gestasional ibu
mellitus dan pengendalian pertumbuhan intrauterin menunjukkan gen umum dan
jalur terkait dengan risiko diabetes tipe 2 berikutnya. FASEB J. 2014:1–12.
71. Morales E, Pengantin Pria A, Lawlor DA, Relton CL. Tanda tangan metilasi DNA di
darah tali pusat terkait dengan penambahan berat badan kehamilan ibu: hasil dari
kelompok ALSPAC. Catatan Res BMC. 2014;7:278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP, dkk.
Diabetes mellitus gestasional secara epigenetik mempengaruhi gen secara dominan
terlibat dalam penyakit metabolik. Epigenetik. 2013;8:935�43.
73. Liu X, Chen Q, Tsai HJ, Wang G, Hong X, Zhou Y, dkk. Keibuan
indeks massa tubuh prakonsepsi dan DNA darah tali pusat
metilasi: eksplorasi awal kehidupan awal penyakit. Lingkungan
Mutagen. 2014;55:223�30.
74. Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF, dkk.
Bayi baru lahir dari orang tua obesitas telah mengubah pola metilasi DNA pada
gen yang dicetak. Int J Obes (London). 2015;39:650�7.
75. Jacobsen SC, Br�ns C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E, dkk.
Efek pemberian makan berlebih jangka pendek dengan lemak tinggi pada DNA genom-lebar
metilasi pada otot rangka pria muda yang sehat. diabetes.
2012; 55: 3341 9.
76. Gillberg L, Jacobsen SC, R�nn T, Br�ns C, Vaag A. DNA PPARGC1A
metilasi dalam jaringan adiposa subkutan pada subjek dengan berat badan lahir rendah�
dampak dari 5 hari overfeeding tinggi lemak. Metabolisme. 2014;63:263�71.
77. Huang YT, Maccani JZJ, Hawley NL, Wing RR, Kelsey KT, McCaffery JM.
Pola epigenetik dalam pemelihara penurunan berat badan yang sukses: studi percontohan. Int J
Obes (London). 2015;39:865�8.
78. Barres R, Kirchner H, Rasmussen M, Yan J, Kantor FR, Krook A, N�slund E,
Zierat JR. Penurunan berat badan setelah operasi bypass lambung pada obesitas manusia
merombak metilasi promotor. Perwakilan Sel 2013:1�8.
79. Ahrens M, Ammerpohl O, von Schnfels W, Kolarova J, Bens S, Itzel T, dkk.
Analisis metilasi DNA pada penyakit hati berlemak nonalkohol menunjukkan
tanda khusus penyakit dan remodeling yang berbeda setelah operasi bariatrik.
Metab Sel. 2013;18:296�302.
80. Voisin S, Eynon N, Yan X, Uskup DJ. Latihan olahraga dan metilasi DNA
pada manusia. Acta Physiol (Oxf). 2014;213:39�59.
81. Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Ekstr�m TJ,
Tegn�r J, dkk. Analisis integratif mengungkapkan pemrograman ulang terkoordinasi
dari epigenom dan transkriptom di otot rangka manusia setelah
pelatihan. Epigenetik. 2014;9:1557�69.
82. Denham J, O'Brien BJ, Marques FZ, Charchar FJ. Perubahan leukosit
methylome dan efeknya pada gen terkait kardiovaskular setelah latihan.
J Appl Fisiol. 2014:jap.00878.2014.
83. Rowlands DS, Halaman RA, Sukala WR, Giri M, Ghimbovschi SD, Hayat I, dkk.
Jaringan terintegrasi multi-omik menghubungkan metilasi DNA dan miRNA dengan
plastisitas otot rangka terhadap latihan kronis pada obesitas diabetes tipe 2.
Genomik Fisiol. 2014;46:747�65.
84. Horvath S, Erhart W, Brosch M, Ammerpohl O, von Schonfels W, Ahrens M,
dkk. Obesitas mempercepat penuaan epigenetik hati manusia. Proc Natl Acad
Sains. 2014;111:15538�43.
85. Alm�n MS, Nilsson EK, Jacobsson JA, Kalnina I, Klovins J, Fredriksson R, dkk.
Analisis seluruh genom mengungkapkan penanda metilasi DNA yang bervariasi dengan
baik usia maupun obesitas. gen. 2014.;548:61�7
86. Houseman EA, Molitor J, Marsit CJ. Penyesuaian campuran sel bebas referensi
dalam analisis data metilasi DNA. Bioinformatika. 2014;30:1431�9.
87. Sumur JC. Sebuah penilaian kritis dari hipotesis respon adaptif prediktif.
Epidemiol Int J. 2012;41:229�35.
88. Williams-Wyss O, Zhang S, MacLaughlin SM, Kleemann D, Walker SK, Suter
CM, dkk. Jumlah embrio dan kekurangan gizi perikonsepsi di
domba memiliki efek diferensial pada epigenotipe adrenal, pertumbuhan, dan
perkembangan. Am J Fisiol Endokrinol Metab. 2014;307:E141�50.
89. Zhang S, Rattanatray L, Morrison JL, Nicholas LM, Lie S, McMillen IC.
Obesitas ibu dan asal mula obesitas masa kanak-kanak: menimbang
manfaat dan biaya penurunan berat badan ibu pada masa perikonsepsi
periode untuk keturunannya. Exp Diabetes Res. 2011;2011:585749.
90. Zhang S, Williams-Wyss O, MacLaughlin SM, Walker SK, Kleemann DO, Suter
CM, dkk. Kekurangan gizi ibu selama minggu pertama setelah pembuahan
menghasilkan penurunan ekspresi mRNA reseptor glukokortikoid di
tidak adanya hipermetilasi GR ekson 17 di hipofisis janin di akhir
kehamilan. J Dev Orig Heal Dis. 2013;4:391�401.
91. Lie S, Morrison JL, Williams-Wyss O, Suter CM, Humphreys DT, Ozanne SE,
dkk. Program kekurangan gizi perikonsepsi mengubah pensinyalan insulin
molekul dan mikroRNA dalam otot rangka pada janin tunggal dan kembar
domba. Biol Repro. 2014;90:5.
92. Van Straten EM, van Meer H, Huijkman NC, van Dijk TH, Baller JF, Verkade
HJ, dkk. Aktivasi reseptor X hati janin secara akut menginduksi lipogenesis tetapi
tidak mempengaruhi respon lipid plasma terhadap diet tinggi lemak pada tikus dewasa. Apakah J
Metab Endokrinol Fisiol. 2009;297:E1171�8.
93. Fernandez-Twinn DS, Alfaradhi MZ, Martin-Gronert MS, Duque-Guimaraes
DE, Piekarz A, Ferland-McCollough D, dkk. Downregulasi IRS-1 di
jaringan adiposa keturunan tikus gemuk diprogram secara selotonom
melalui mekanisme pasca-transkripsi. Mol Metab.
2014; 3: 325 33.
94. Waterland RA, Travisano M, Tahiliani KG. Hipermetilasi yang diinduksi oleh diet pada
agouti kuning yang hidup tidak diwariskan secara transgenerasi melalui betina.
FASEB J.2007;21:3380�5.
95. Ge ZJ, Luo SM, Lin F, Liang QX, Huang L, Wei YC, dkk. metilasi DNA dalam
oosit dan hati tikus betina dan keturunannya: efek dari diet tinggi lemak yang diinduksi
kegemukan. Env Menyembuhkan Perspektif. 2014;122:159�64.
96. Ollikainen M, Ismail K, Gervin K, Kyllnen A, Hakkarainen A, Lundbom J, dkk.
Perubahan metilasi DNA darah genome pada elemen pengatur
dan daerah heterokromatik pada kembar monozigot yang sumbang untuk obesitas
dan lemak hati. Clin Epigenetics. 2015; 7: 1 13.








 Obesitas adalah penyakit multifaktorial yang kompleks, dan pemahaman mekanisme yang mendasari interaksi antara gaya hidup, lingkungan, dan genetika sangat penting untuk mengembangkan strategi pencegahan dan pengobatan yang efektif [1].
Obesitas adalah penyakit multifaktorial yang kompleks, dan pemahaman mekanisme yang mendasari interaksi antara gaya hidup, lingkungan, dan genetika sangat penting untuk mengembangkan strategi pencegahan dan pengobatan yang efektif [1]. Model hewan memberikan peluang unik untuk studi yang sangat terkontrol yang memberikan wawasan mekanistik tentang peran tanda epigenetik spesifik, baik sebagai indikator status metabolisme saat ini maupun sebagai prediktor risiko obesitas dan penyakit metabolik di masa depan. Aspek yang sangat penting dari penelitian pada hewan adalah bahwa mereka memungkinkan penilaian perubahan epigenetik dalam jaringan target, termasuk hati dan hipotalamus, yang jauh lebih sulit pada manusia. Selain itu, kemampuan untuk memanen sejumlah besar jaringan segar memungkinkan untuk menilai beberapa tanda kromatin serta metilasi DNA. Beberapa modifikasi epigenetik ini baik sendiri atau dalam kombinasi mungkin responsif terhadap pemrograman lingkungan. Dalam model hewan, juga dimungkinkan untuk mempelajari beberapa generasi keturunan dan dengan demikian memungkinkan diferensiasi antara transmisi risiko obesitas trans-generasi dan antargenerasi yang dimediasi oleh memori epigenetik status gizi orang tua, yang tidak dapat dengan mudah dibedakan dalam penelitian pada manusia. Kami menggunakan istilah sebelumnya untuk transmisi meiosis risiko tanpa adanya paparan lanjutan sementara yang terakhir terutama memerlukan transmisi langsung risiko melalui pemrograman ulang metabolik janin atau gamet.
Model hewan memberikan peluang unik untuk studi yang sangat terkontrol yang memberikan wawasan mekanistik tentang peran tanda epigenetik spesifik, baik sebagai indikator status metabolisme saat ini maupun sebagai prediktor risiko obesitas dan penyakit metabolik di masa depan. Aspek yang sangat penting dari penelitian pada hewan adalah bahwa mereka memungkinkan penilaian perubahan epigenetik dalam jaringan target, termasuk hati dan hipotalamus, yang jauh lebih sulit pada manusia. Selain itu, kemampuan untuk memanen sejumlah besar jaringan segar memungkinkan untuk menilai beberapa tanda kromatin serta metilasi DNA. Beberapa modifikasi epigenetik ini baik sendiri atau dalam kombinasi mungkin responsif terhadap pemrograman lingkungan. Dalam model hewan, juga dimungkinkan untuk mempelajari beberapa generasi keturunan dan dengan demikian memungkinkan diferensiasi antara transmisi risiko obesitas trans-generasi dan antargenerasi yang dimediasi oleh memori epigenetik status gizi orang tua, yang tidak dapat dengan mudah dibedakan dalam penelitian pada manusia. Kami menggunakan istilah sebelumnya untuk transmisi meiosis risiko tanpa adanya paparan lanjutan sementara yang terakhir terutama memerlukan transmisi langsung risiko melalui pemrograman ulang metabolik janin atau gamet.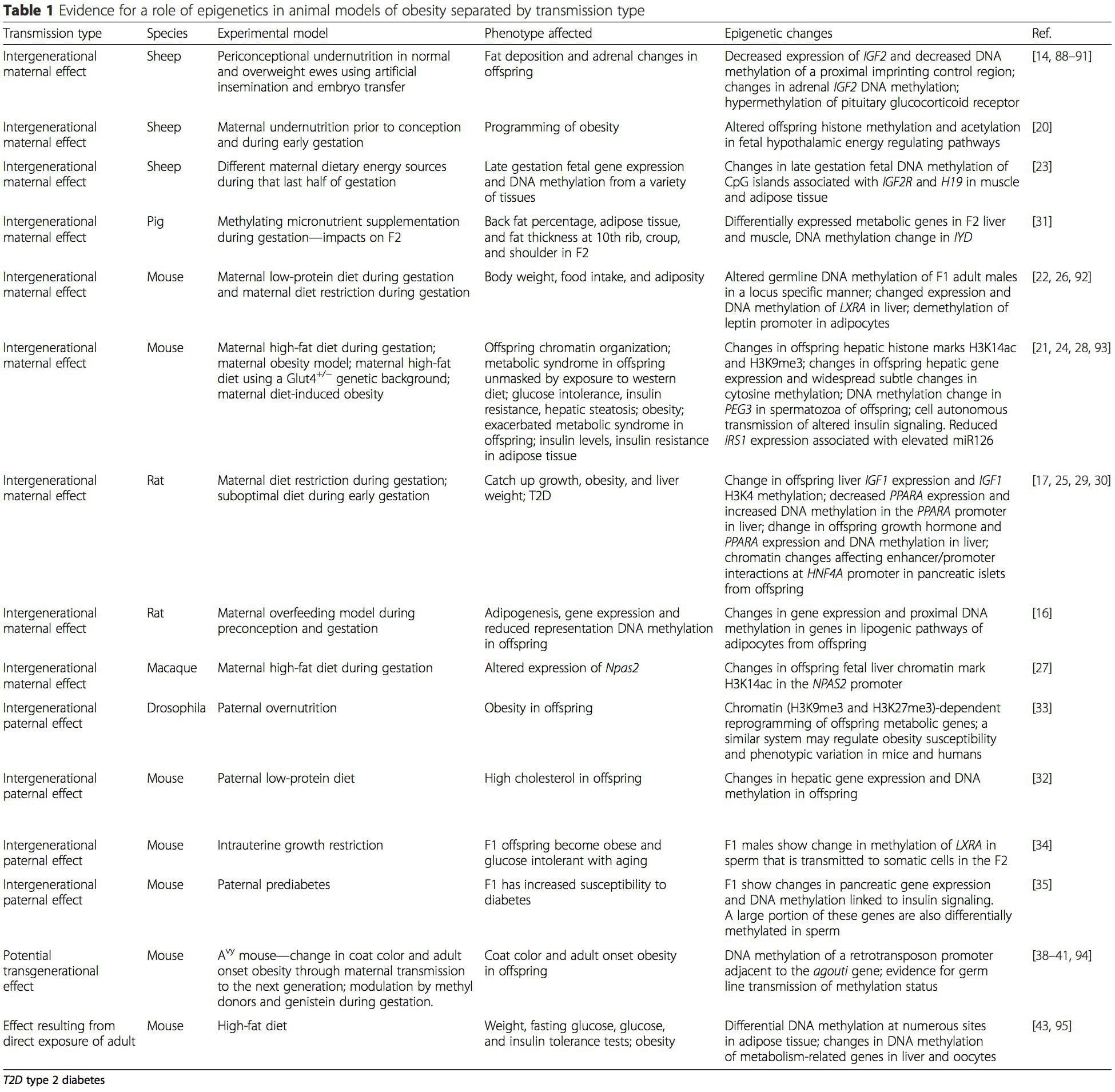 (i) Perubahan Epigenetik Pada Anak yang Berhubungan Dengan Nutrisi Ibu Selama Gestasi
(i) Perubahan Epigenetik Pada Anak yang Berhubungan Dengan Nutrisi Ibu Selama Gestasi Suplementasi gizi ibu, gizi kurang, dan gizi lebih selama kehamilan dapat mengubah deposisi lemak dan homeostasis energi pada keturunannya [11, 13-15, 19]. Terkait dengan efek ini pada keturunannya adalah perubahan dalam metilasi DNA, modifikasi histon pasca-translasi, dan ekspresi gen untuk beberapa gen target, terutama gen yang mengatur metabolisme asam lemak dan pensinyalan insulin [16, 17, 20-30]. Keragaman model hewan yang digunakan dalam studi ini dan jalur metabolisme umum yang terpengaruh menunjukkan respons adaptif yang dilestarikan secara evolusioner yang dimediasi oleh modifikasi epigenetik. Namun, beberapa gen spesifik yang diidentifikasi dan perubahan epigenetik telah divalidasi silang dalam penelitian terkait, dan penyelidikan luas genom skala besar biasanya tidak diterapkan. Hambatan utama untuk membandingkan studi ini adalah perbedaan jendela perkembangan mental yang mengalami tantangan nutrisi, yang dapat menyebabkan hasil yang sangat berbeda. Bukti bahwa perubahan epigenetik adalah kausal daripada dikaitkan dengan perubahan fenotipik keturunan juga diperlukan. Ini akan memerlukan identifikasi respons 'memori' epigenetik yang diinduksi oleh nutrisi parental yang mendahului perkembangan fenotipe yang diubah pada keturunannya.
Suplementasi gizi ibu, gizi kurang, dan gizi lebih selama kehamilan dapat mengubah deposisi lemak dan homeostasis energi pada keturunannya [11, 13-15, 19]. Terkait dengan efek ini pada keturunannya adalah perubahan dalam metilasi DNA, modifikasi histon pasca-translasi, dan ekspresi gen untuk beberapa gen target, terutama gen yang mengatur metabolisme asam lemak dan pensinyalan insulin [16, 17, 20-30]. Keragaman model hewan yang digunakan dalam studi ini dan jalur metabolisme umum yang terpengaruh menunjukkan respons adaptif yang dilestarikan secara evolusioner yang dimediasi oleh modifikasi epigenetik. Namun, beberapa gen spesifik yang diidentifikasi dan perubahan epigenetik telah divalidasi silang dalam penelitian terkait, dan penyelidikan luas genom skala besar biasanya tidak diterapkan. Hambatan utama untuk membandingkan studi ini adalah perbedaan jendela perkembangan mental yang mengalami tantangan nutrisi, yang dapat menyebabkan hasil yang sangat berbeda. Bukti bahwa perubahan epigenetik adalah kausal daripada dikaitkan dengan perubahan fenotipik keturunan juga diperlukan. Ini akan memerlukan identifikasi respons 'memori' epigenetik yang diinduksi oleh nutrisi parental yang mendahului perkembangan fenotipe yang diubah pada keturunannya. Studi yang muncul telah menunjukkan bahwa bidang nutrisi ayah dapat mempengaruhi deposisi lemak keturunan dan tanda epigenetik [31]. Satu penyelidikan baru-baru ini menggunakan tikus telah menunjukkan bahwa pra-diabetes ayah menyebabkan peningkatan kerentanan terhadap diabetes pada keturunan F34 dengan perubahan terkait dalam ekspresi gen pankreas dan metilasi DNA terkait dengan pensinyalan insulin [1]. Yang penting, ada tumpang tindih dari perubahan epigenetik di pulau pankreas dan sperma yang menunjukkan pewarisan garis kuman. Namun, sebagian besar studi ini, meskipun menarik dalam implikasinya, terbatas dalam skala penyelidikan genom dan sering menunjukkan perubahan epigenetik yang lemah dan agak sementara yang terkait dengan fenotipe metabolik ringan pada keturunannya.
Studi yang muncul telah menunjukkan bahwa bidang nutrisi ayah dapat mempengaruhi deposisi lemak keturunan dan tanda epigenetik [31]. Satu penyelidikan baru-baru ini menggunakan tikus telah menunjukkan bahwa pra-diabetes ayah menyebabkan peningkatan kerentanan terhadap diabetes pada keturunan F34 dengan perubahan terkait dalam ekspresi gen pankreas dan metilasi DNA terkait dengan pensinyalan insulin [1]. Yang penting, ada tumpang tindih dari perubahan epigenetik di pulau pankreas dan sperma yang menunjukkan pewarisan garis kuman. Namun, sebagian besar studi ini, meskipun menarik dalam implikasinya, terbatas dalam skala penyelidikan genom dan sering menunjukkan perubahan epigenetik yang lemah dan agak sementara yang terkait dengan fenotipe metabolik ringan pada keturunannya.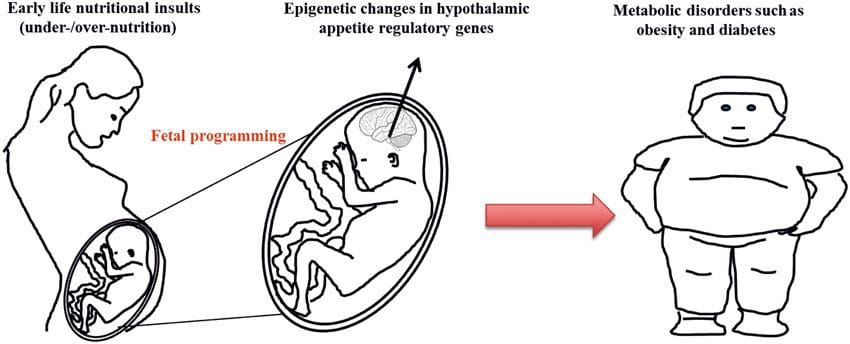 Transmisi stabil informasi epigenetik di beberapa generasi dijelaskan dengan baik dalam sistem tanaman dan C. elegans, tetapi signifikansinya pada mamalia masih banyak diperdebatkan [36, 37]. Dasar epigenetik untuk transmisi fenotipe kakek-nenek sebagai respons terhadap paparan makanan telah ditetapkan dengan baik, termasuk pada spesies ternak [31]. Studi paling berpengaruh yang menunjukkan efek transmisi epigenetik yang berdampak pada fenotipe keturunan telah menggunakan contoh tikus agouti kuning (Avy) yang layak [38]. Pada tikus ini, penyisipan retrotransposon hulu gen agouti menyebabkan ekspresi konstitutif dan warna bulu kuning konsekuen dan obesitas onset dewasa. Transmisi ibu melalui garis germinal menghasilkan pembungkaman ekspresi agouti yang dimediasi metilasi DNA yang menghasilkan warna bulu tipe liar dan fenotipe ramping dari keturunannya [39, 40]. Yang penting, penelitian selanjutnya pada tikus ini menunjukkan bahwa paparan ibu terhadap donor metil menyebabkan perubahan warna bulu [41]. Satu studi telah melaporkan transmisi fenotipe ke generasi F3 dan perubahan ekspresi sejumlah besar gen dalam menanggapi pembatasan protein di F0 [42]; namun, perubahan ekspresi sangat bervariasi dan hubungan langsung dengan perubahan epigenetik tidak diidentifikasi dalam sistem ini.
Transmisi stabil informasi epigenetik di beberapa generasi dijelaskan dengan baik dalam sistem tanaman dan C. elegans, tetapi signifikansinya pada mamalia masih banyak diperdebatkan [36, 37]. Dasar epigenetik untuk transmisi fenotipe kakek-nenek sebagai respons terhadap paparan makanan telah ditetapkan dengan baik, termasuk pada spesies ternak [31]. Studi paling berpengaruh yang menunjukkan efek transmisi epigenetik yang berdampak pada fenotipe keturunan telah menggunakan contoh tikus agouti kuning (Avy) yang layak [38]. Pada tikus ini, penyisipan retrotransposon hulu gen agouti menyebabkan ekspresi konstitutif dan warna bulu kuning konsekuen dan obesitas onset dewasa. Transmisi ibu melalui garis germinal menghasilkan pembungkaman ekspresi agouti yang dimediasi metilasi DNA yang menghasilkan warna bulu tipe liar dan fenotipe ramping dari keturunannya [39, 40]. Yang penting, penelitian selanjutnya pada tikus ini menunjukkan bahwa paparan ibu terhadap donor metil menyebabkan perubahan warna bulu [41]. Satu studi telah melaporkan transmisi fenotipe ke generasi F3 dan perubahan ekspresi sejumlah besar gen dalam menanggapi pembatasan protein di F0 [42]; namun, perubahan ekspresi sangat bervariasi dan hubungan langsung dengan perubahan epigenetik tidak diidentifikasi dalam sistem ini.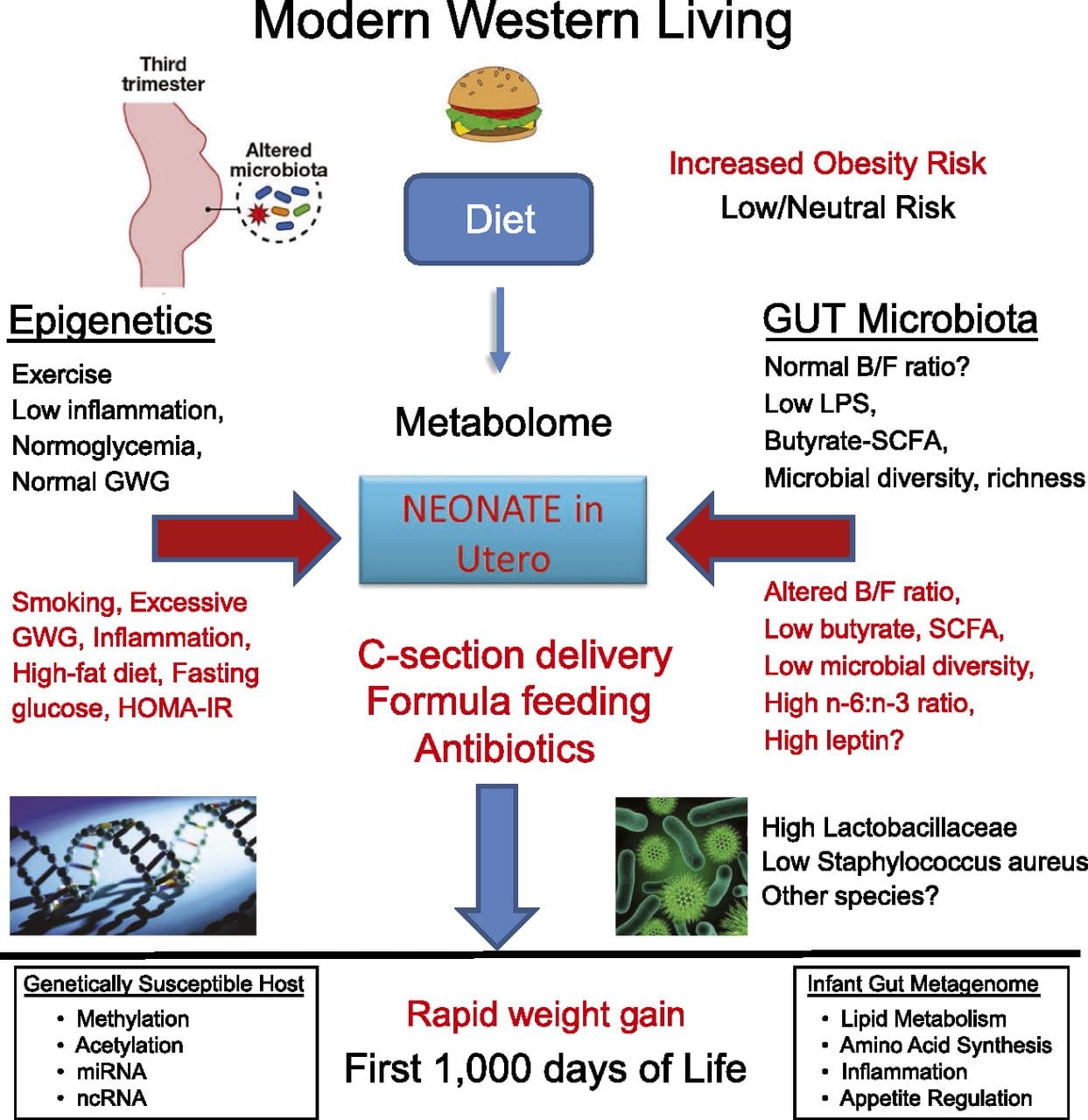 Sementara banyak penelitian telah mengidentifikasi perubahan epigenetik terkait diet pada model hewan dengan menggunakan daerah spesifik kandidat, hanya sedikit analisis genom yang dilakukan. Sebuah studi baru-baru ini berfokus pada penentuan dampak epigenetik langsung dari diet tinggi lemak / diet yang menyebabkan obesitas pada tikus dewasa dengan menggunakan ekspresi genom genom dan analisis metilasi DNA [43]. Penelitian ini mengidentifikasi 232 daerah metilasi yang berbeda (DMR) pada adiposit dari kontrol dan tikus dengan kadar tinggi. Yang penting, daerah manusia yang sesuai untuk DMR murine juga dimetilasi secara berbeda dalam jaringan adiposa dari populasi manusia gemuk dan kurus, sehingga menyoroti konservasi evolusioner yang luar biasa di wilayah ini. Hasil ini menekankan pentingnya DMR yang teridentifikasi dalam mengatur homeostasis energi pada mamalia.
Sementara banyak penelitian telah mengidentifikasi perubahan epigenetik terkait diet pada model hewan dengan menggunakan daerah spesifik kandidat, hanya sedikit analisis genom yang dilakukan. Sebuah studi baru-baru ini berfokus pada penentuan dampak epigenetik langsung dari diet tinggi lemak / diet yang menyebabkan obesitas pada tikus dewasa dengan menggunakan ekspresi genom genom dan analisis metilasi DNA [43]. Penelitian ini mengidentifikasi 232 daerah metilasi yang berbeda (DMR) pada adiposit dari kontrol dan tikus dengan kadar tinggi. Yang penting, daerah manusia yang sesuai untuk DMR murine juga dimetilasi secara berbeda dalam jaringan adiposa dari populasi manusia gemuk dan kurus, sehingga menyoroti konservasi evolusioner yang luar biasa di wilayah ini. Hasil ini menekankan pentingnya DMR yang teridentifikasi dalam mengatur homeostasis energi pada mamalia.
 (i) Studi asosiasi genetika. Polimorfisme genetik yang terkait dengan peningkatan risiko mengembangkan kondisi tertentu secara apriori terkait dengan gen penyebab. Kehadiran metilasi diferensial di wilayah tersebut menyimpulkan relevansi fungsional dari perubahan epigenetik ini dalam mengendalikan ekspresi gen proksimal. Ada efek genetik cis-acting yang kuat yang mendasari banyak variasi epigenetik [7, 45], dan dalam studi berbasis populasi, metode yang menggunakan pengganti genetik untuk menyimpulkan peran kausal atau mediasi perbedaan epigenom telah diterapkan [7, 46-48] . Penggunaan informasi genetik familial juga dapat mengarah pada identifikasi daerah kandidat penyebab potensial yang menunjukkan metilasi diferensial terkait fenotipe [49].
(i) Studi asosiasi genetika. Polimorfisme genetik yang terkait dengan peningkatan risiko mengembangkan kondisi tertentu secara apriori terkait dengan gen penyebab. Kehadiran metilasi diferensial di wilayah tersebut menyimpulkan relevansi fungsional dari perubahan epigenetik ini dalam mengendalikan ekspresi gen proksimal. Ada efek genetik cis-acting yang kuat yang mendasari banyak variasi epigenetik [7, 45], dan dalam studi berbasis populasi, metode yang menggunakan pengganti genetik untuk menyimpulkan peran kausal atau mediasi perbedaan epigenom telah diterapkan [7, 46-48] . Penggunaan informasi genetik familial juga dapat mengarah pada identifikasi daerah kandidat penyebab potensial yang menunjukkan metilasi diferensial terkait fenotipe [49].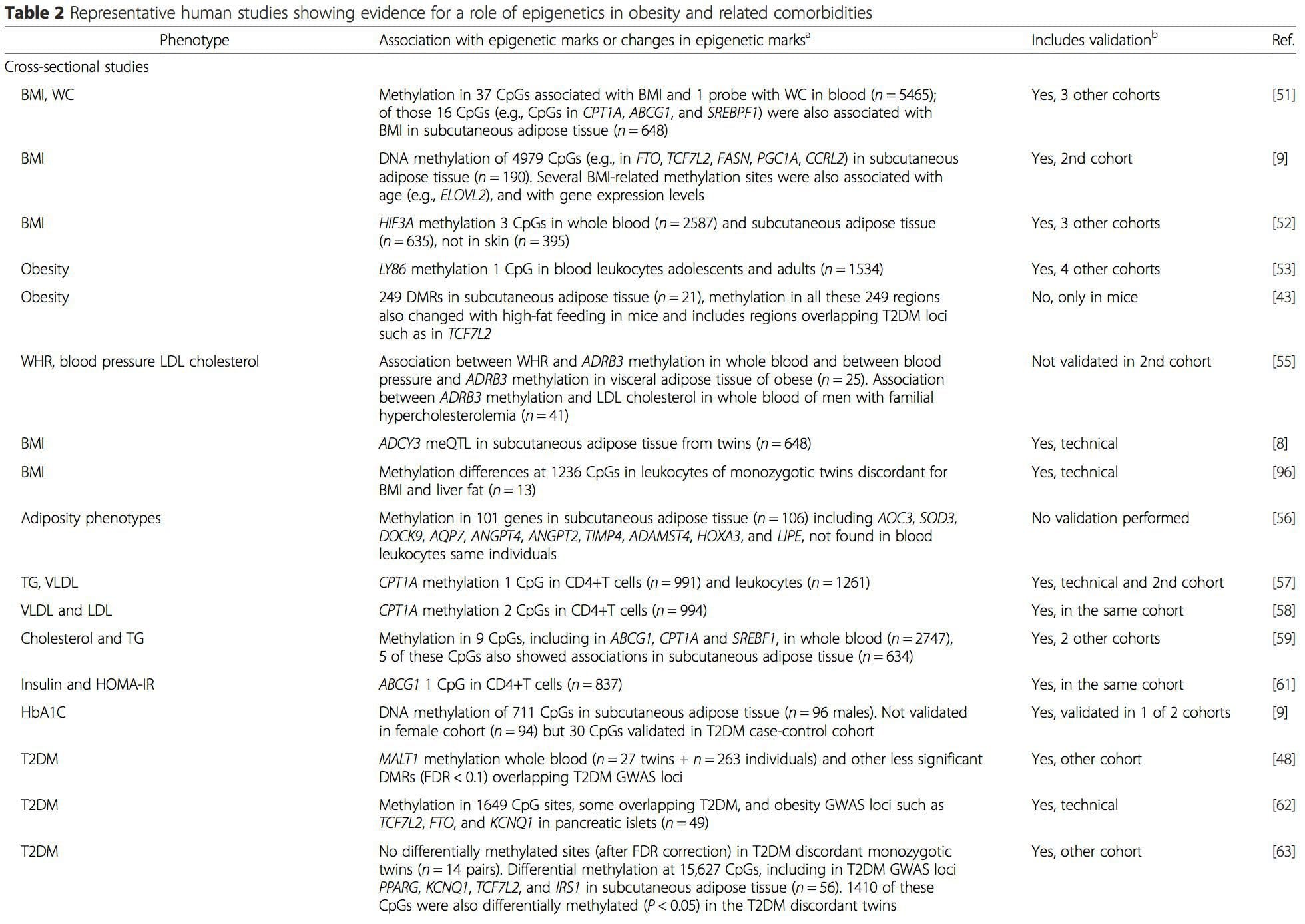
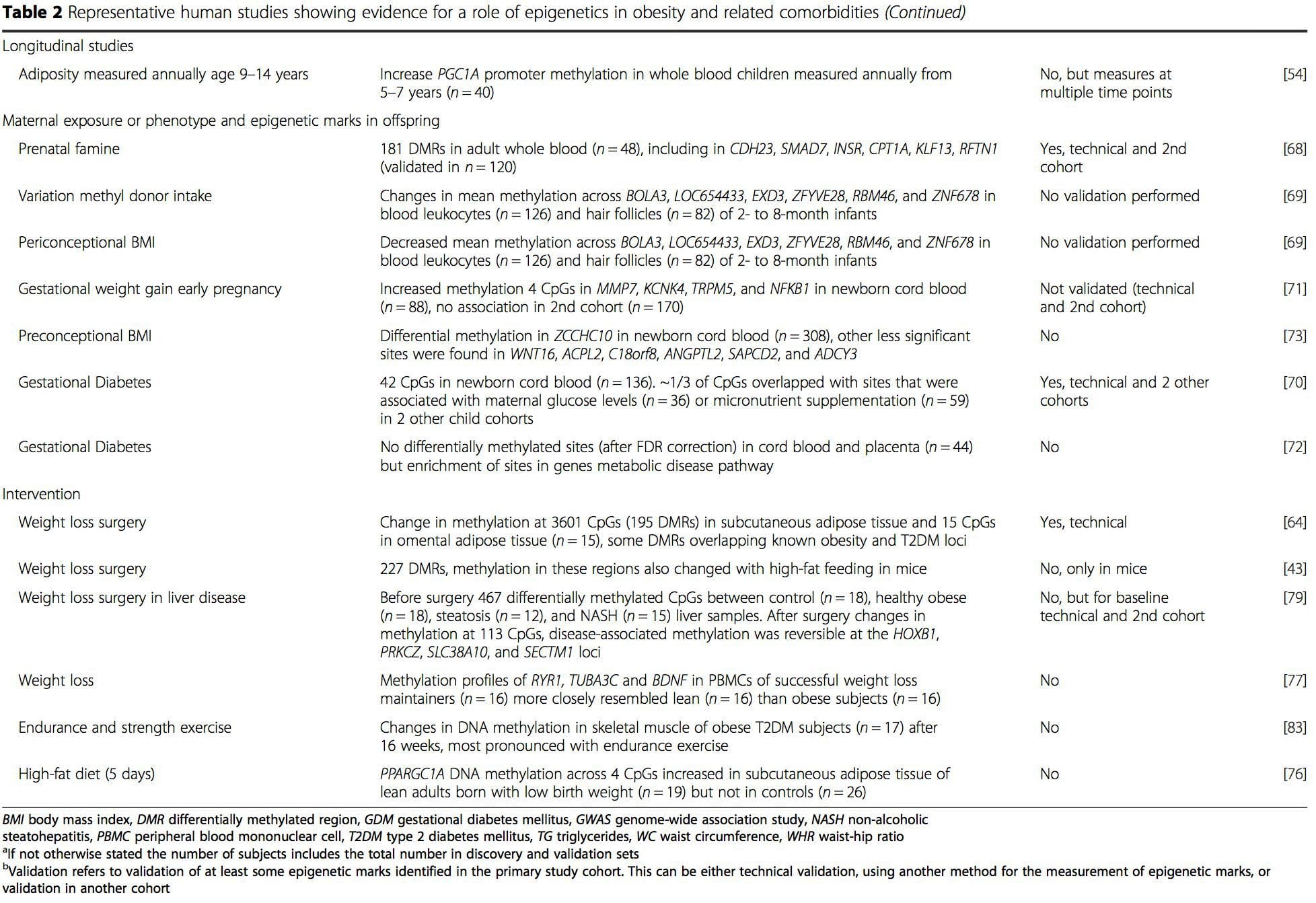 Dari penelitian ini, diubah metilasi PGC1A, HIF3A, ABCG1, dan CPT1A dan RXRA [18] yang telah dijelaskan sebelumnya telah muncul sebagai biomarker yang terkait dengan, atau mungkin prediktif, kesehatan metabolik yang juga merupakan kandidat yang masuk akal untuk berperan dalam pengembangan penyakit metabolik. .
Dari penelitian ini, diubah metilasi PGC1A, HIF3A, ABCG1, dan CPT1A dan RXRA [18] yang telah dijelaskan sebelumnya telah muncul sebagai biomarker yang terkait dengan, atau mungkin prediktif, kesehatan metabolik yang juga merupakan kandidat yang masuk akal untuk berperan dalam pengembangan penyakit metabolik. .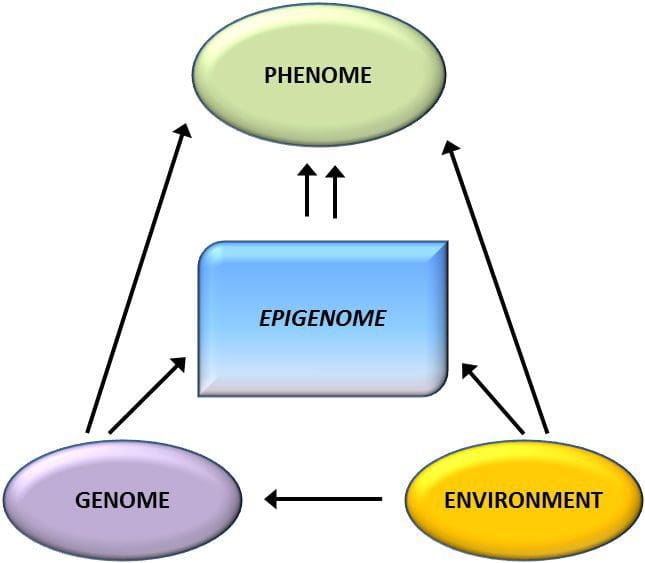 Variasi epigenetik sangat dipengaruhi oleh variasi genetik yang mendasarinya, dengan genotipe diperkirakan menjelaskan ~20-40% variasi [6, 8]. Baru-baru ini, sejumlah penelitian telah mulai mengintegrasikan data metilom dan genotipe untuk mengidentifikasi lokus sifat kuantitatif metilasi (meQTL) yang terkait dengan fenotipe penyakit. Misalnya, dalam jaringan adiposa, meQTL yang tumpang tindih dengan lokus risiko genetik BMI telah diidentifikasi dalam elemen penambah hulu ADCY3 [8]. Penelitian lain juga telah mengidentifikasi tumpang tindih antara obesitas yang diketahui dan lokus risiko T2DM dan DMR yang terkait dengan obesitas dan DMT2 [43, 48, 62]. Metilasi sejumlah DMR semacam itu juga dimodulasi oleh pemberian makanan berlemak tinggi pada tikus [43] dan penurunan berat badan pada manusia [64]. Hasil ini mengidentifikasi hubungan yang menarik antara variasi genetik yang terkait dengan kerentanan penyakit dan hubungannya dengan daerah genom yang mengalami modifikasi epigenetik sebagai respons terhadap tantangan nutrisi, yang menyiratkan hubungan sebab akibat. Hubungan erat antara variasi genetik dan epigenetik dapat menandakan peran penting mereka dalam menghasilkan variasi individu [65, 66]. Namun, sementara temuan ini menunjukkan bahwa metilasi DNA mungkin menjadi mediator efek genetik, penting juga untuk mempertimbangkan bahwa proses genetik dan epigenetik dapat bertindak secara independen pada gen yang sama. Studi kembar [8, 63, 67] dapat memberikan wawasan penting dan menunjukkan bahwa perbedaan antar individu dalam tingkat metilasi DNA muncul terutama dari lingkungan non-berbagi dan pengaruh stokastik, minimal dari efek lingkungan bersama, tetapi juga dengan dampak genetik yang signifikan. variasi.
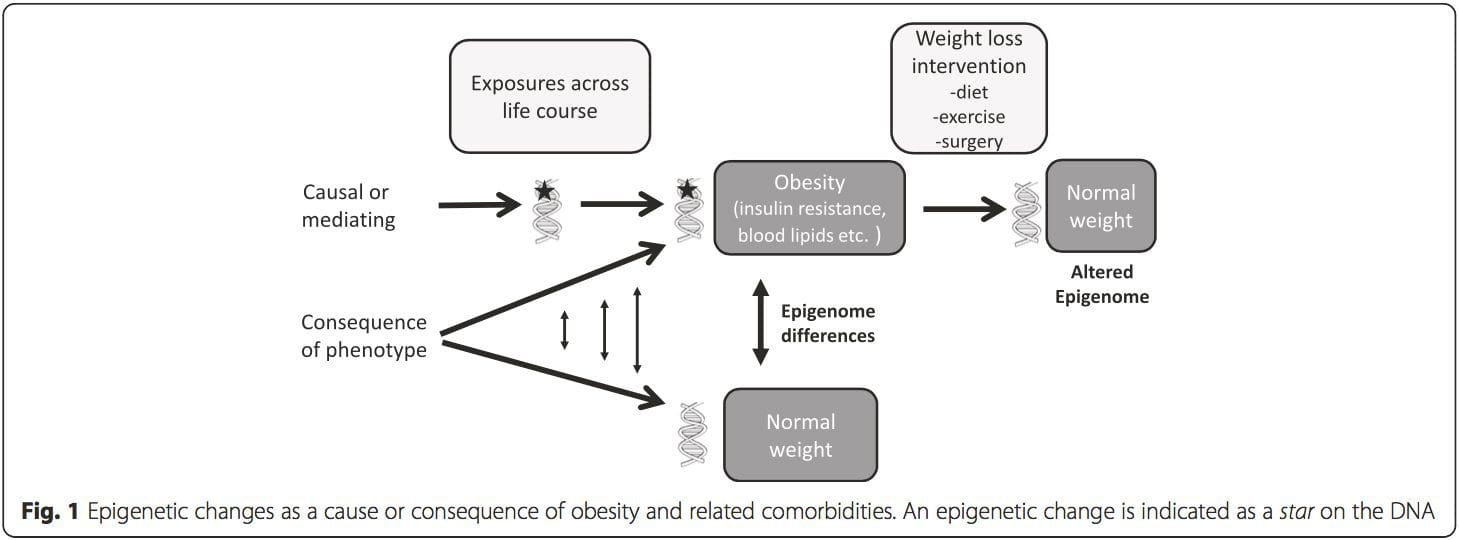
Variasi epigenetik sangat dipengaruhi oleh variasi genetik yang mendasarinya, dengan genotipe diperkirakan menjelaskan ~20-40% variasi [6, 8]. Baru-baru ini, sejumlah penelitian telah mulai mengintegrasikan data metilom dan genotipe untuk mengidentifikasi lokus sifat kuantitatif metilasi (meQTL) yang terkait dengan fenotipe penyakit. Misalnya, dalam jaringan adiposa, meQTL yang tumpang tindih dengan lokus risiko genetik BMI telah diidentifikasi dalam elemen penambah hulu ADCY3 [8]. Penelitian lain juga telah mengidentifikasi tumpang tindih antara obesitas yang diketahui dan lokus risiko T2DM dan DMR yang terkait dengan obesitas dan DMT2 [43, 48, 62]. Metilasi sejumlah DMR semacam itu juga dimodulasi oleh pemberian makanan berlemak tinggi pada tikus [43] dan penurunan berat badan pada manusia [64]. Hasil ini mengidentifikasi hubungan yang menarik antara variasi genetik yang terkait dengan kerentanan penyakit dan hubungannya dengan daerah genom yang mengalami modifikasi epigenetik sebagai respons terhadap tantangan nutrisi, yang menyiratkan hubungan sebab akibat. Hubungan erat antara variasi genetik dan epigenetik dapat menandakan peran penting mereka dalam menghasilkan variasi individu [65, 66]. Namun, sementara temuan ini menunjukkan bahwa metilasi DNA mungkin menjadi mediator efek genetik, penting juga untuk mempertimbangkan bahwa proses genetik dan epigenetik dapat bertindak secara independen pada gen yang sama. Studi kembar [8, 63, 67] dapat memberikan wawasan penting dan menunjukkan bahwa perbedaan antar individu dalam tingkat metilasi DNA muncul terutama dari lingkungan non-berbagi dan pengaruh stokastik, minimal dari efek lingkungan bersama, tetapi juga dengan dampak genetik yang signifikan. variasi.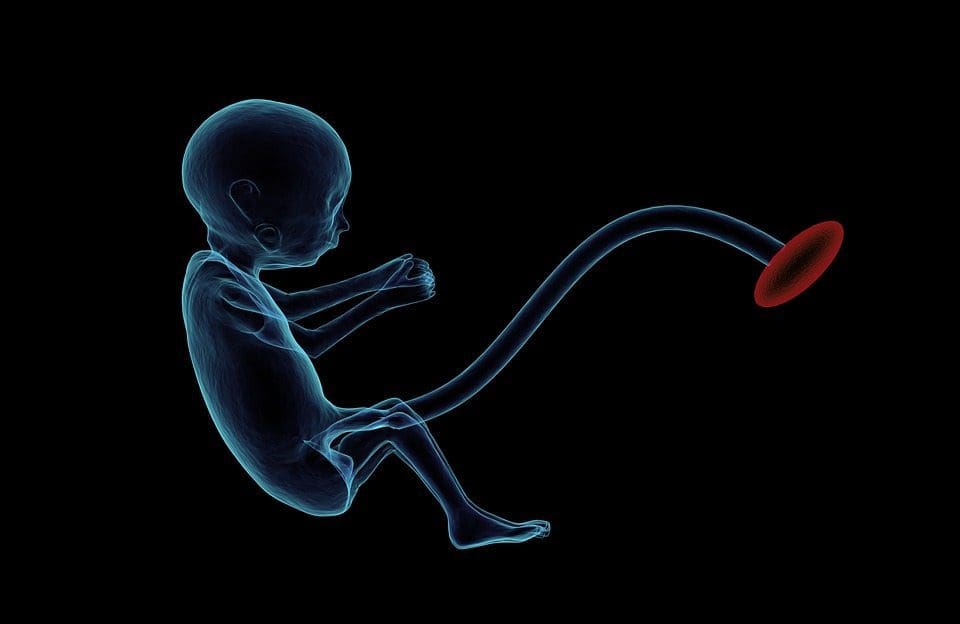 Lingkungan prenatal: Dua studi yang baru-baru ini diterbitkan menggunakan populasi manusia yang mengalami variasi 'alami' dalam pasokan nutrisi untuk mempelajari dampak nutrisi ibu sebelum atau selama kehamilan pada metilasi DNA pada keturunan [68, 69]. Studi pertama menggunakan kohort ibu-anak Gambia untuk menunjukkan bahwa variasi musiman dalam asupan metil donor ibu selama kehamilan dan BMI ibu sebelum kehamilan dikaitkan dengan perubahan metilasi pada bayi [69]. Studi kedua memanfaatkan keturunan dewasa dari kelompok Dutch Hunger Winter untuk menyelidiki pengaruh paparan prenatal ke periode akut kekurangan gizi ibu yang parah pada metilasi DNA dari gen yang terlibat dalam pertumbuhan dan metabolisme di masa dewasa [68]. Hasilnya menyoroti pentingnya waktu pemaparan dalam dampaknya pada epigenom, karena efek epigenetik yang signifikan hanya diidentifikasi pada individu yang terpapar kelaparan selama awal kehamilan. Yang penting, perubahan epigenetik terjadi sehubungan dengan peningkatan BMI; Namun, tidak mungkin untuk menetapkan dalam penelitian ini apakah perubahan ini terjadi di awal kehidupan atau konsekuensi dari BMI yang lebih tinggi.
Lingkungan prenatal: Dua studi yang baru-baru ini diterbitkan menggunakan populasi manusia yang mengalami variasi 'alami' dalam pasokan nutrisi untuk mempelajari dampak nutrisi ibu sebelum atau selama kehamilan pada metilasi DNA pada keturunan [68, 69]. Studi pertama menggunakan kohort ibu-anak Gambia untuk menunjukkan bahwa variasi musiman dalam asupan metil donor ibu selama kehamilan dan BMI ibu sebelum kehamilan dikaitkan dengan perubahan metilasi pada bayi [69]. Studi kedua memanfaatkan keturunan dewasa dari kelompok Dutch Hunger Winter untuk menyelidiki pengaruh paparan prenatal ke periode akut kekurangan gizi ibu yang parah pada metilasi DNA dari gen yang terlibat dalam pertumbuhan dan metabolisme di masa dewasa [68]. Hasilnya menyoroti pentingnya waktu pemaparan dalam dampaknya pada epigenom, karena efek epigenetik yang signifikan hanya diidentifikasi pada individu yang terpapar kelaparan selama awal kehamilan. Yang penting, perubahan epigenetik terjadi sehubungan dengan peningkatan BMI; Namun, tidak mungkin untuk menetapkan dalam penelitian ini apakah perubahan ini terjadi di awal kehidupan atau konsekuensi dari BMI yang lebih tinggi. Lingkungan pascakelahiran: Epigenom dibentuk de novo selama perkembangan embrio, dan oleh karena itu, lingkungan prenatal kemungkinan besar memiliki dampak paling signifikan pada epigenom. Namun, sekarang jelas bahwa perubahan memang terjadi pada epigenom 'matang' di bawah pengaruh berbagai kondisi, termasuk penuaan, paparan racun, dan perubahan pola makan. Sebagai contoh, perubahan metilasi DNA pada berbagai gen di otot rangka dan PGC1A di jaringan adiposa telah dibuktikan sebagai respons terhadap diet tinggi lemak [75, 76]. Intervensi untuk menghilangkan massa lemak tubuh juga dikaitkan dengan perubahan metilasi DNA. Studi telah melaporkan bahwa profil metilasi DNA dari jaringan adiposa [43, 64], sel mononuklear darah perifer [77], dan jaringan otot [78] pada pasien obesitas sebelumnya menjadi lebih mirip dengan profil subjek kurus setelah penurunan berat badan. Operasi penurunan berat badan juga sebagian membalikkan perubahan metilasi terkait penyakit hati berlemak non-alkoholik di hati [79] dan dalam penelitian lain menyebabkan hipometilasi dari beberapa gen kandidat obesitas, dengan efek yang lebih menonjol pada subkutan dibandingkan dengan lemak omental (viseral) [64] . Bukti yang terkumpul menunjukkan bahwa intervensi olahraga juga dapat memengaruhi metilasi DNA. Sebagian besar studi ini telah dilakukan pada individu kurus [80-82], tetapi satu studi olahraga pada subjek T2DM obesitas juga menunjukkan perubahan dalam metilasi DNA, termasuk dalam gen yang terlibat dalam transportasi asam lemak dan glukosa [83]. Perubahan epigenetik juga terjadi dengan penuaan, dan data terbaru menunjukkan peran obesitas dalam menambahnya [9, 84, 85]. Obesitas mempercepat usia epigenetik jaringan hati, tetapi berbeda dengan temuan yang dijelaskan di atas, efek ini tidak dapat dipulihkan setelah penurunan berat badan [84].
Lingkungan pascakelahiran: Epigenom dibentuk de novo selama perkembangan embrio, dan oleh karena itu, lingkungan prenatal kemungkinan besar memiliki dampak paling signifikan pada epigenom. Namun, sekarang jelas bahwa perubahan memang terjadi pada epigenom 'matang' di bawah pengaruh berbagai kondisi, termasuk penuaan, paparan racun, dan perubahan pola makan. Sebagai contoh, perubahan metilasi DNA pada berbagai gen di otot rangka dan PGC1A di jaringan adiposa telah dibuktikan sebagai respons terhadap diet tinggi lemak [75, 76]. Intervensi untuk menghilangkan massa lemak tubuh juga dikaitkan dengan perubahan metilasi DNA. Studi telah melaporkan bahwa profil metilasi DNA dari jaringan adiposa [43, 64], sel mononuklear darah perifer [77], dan jaringan otot [78] pada pasien obesitas sebelumnya menjadi lebih mirip dengan profil subjek kurus setelah penurunan berat badan. Operasi penurunan berat badan juga sebagian membalikkan perubahan metilasi terkait penyakit hati berlemak non-alkoholik di hati [79] dan dalam penelitian lain menyebabkan hipometilasi dari beberapa gen kandidat obesitas, dengan efek yang lebih menonjol pada subkutan dibandingkan dengan lemak omental (viseral) [64] . Bukti yang terkumpul menunjukkan bahwa intervensi olahraga juga dapat memengaruhi metilasi DNA. Sebagian besar studi ini telah dilakukan pada individu kurus [80-82], tetapi satu studi olahraga pada subjek T2DM obesitas juga menunjukkan perubahan dalam metilasi DNA, termasuk dalam gen yang terlibat dalam transportasi asam lemak dan glukosa [83]. Perubahan epigenetik juga terjadi dengan penuaan, dan data terbaru menunjukkan peran obesitas dalam menambahnya [9, 84, 85]. Obesitas mempercepat usia epigenetik jaringan hati, tetapi berbeda dengan temuan yang dijelaskan di atas, efek ini tidak dapat dipulihkan setelah penurunan berat badan [84].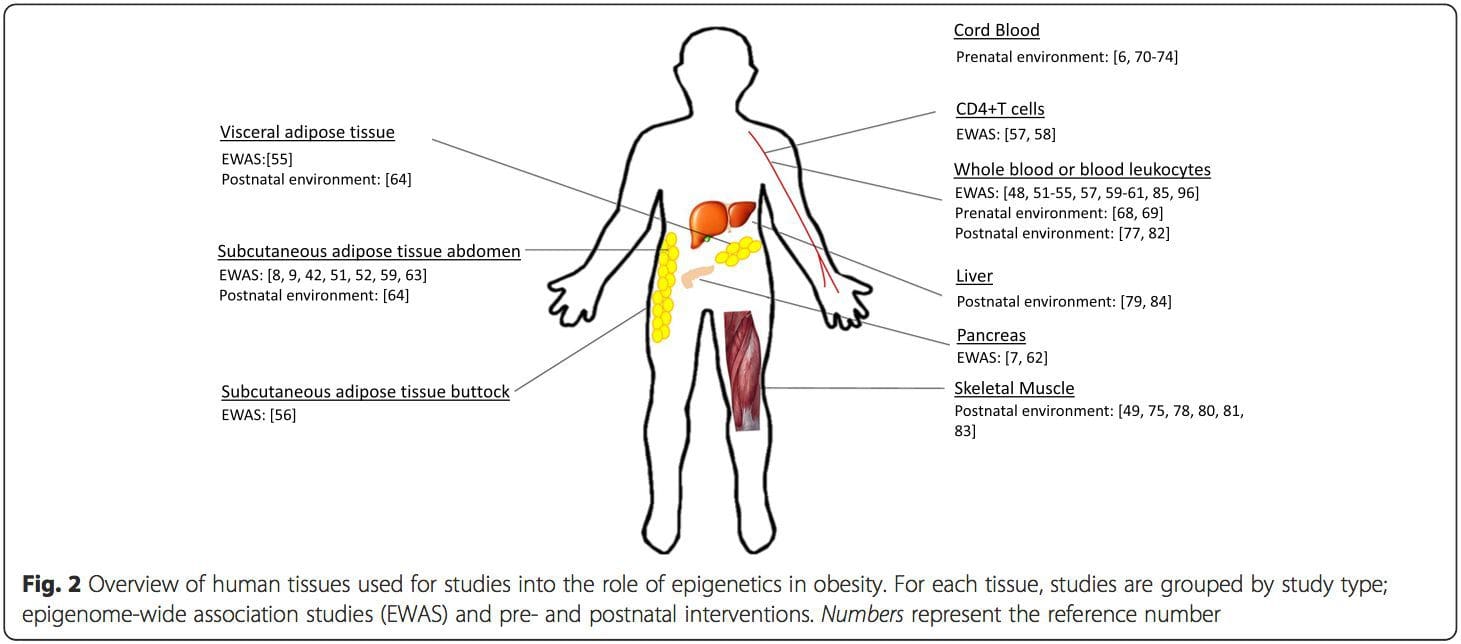 Kesimpulan
Kesimpulan



