Neuroinflamasi:
Abstrak
Beberapa baris bukti mendukung peran patogenik neuroinflamasi pada penyakit kejiwaan. Sementara penyakit autoimun sistemik didokumentasikan dengan baik penyebab gangguan neuropsikiatri, ensefalitis autoimun sinaptik dengan gejala psikotik sering tidak dikenali. Sejalan dengan kaitan antara gejala kejiwaan dan autoimunitas pada penyakit autoimun, kelainan neuroimunologis terjadi pada gangguan kejiwaan klasik (misalnya, depresi mayor, bipolar, skizofrenia, dan gangguan obsesif-kompulsif). Investigasi terhadap patofisiologi kondisi ini secara tradisional menekankan disregulasi sistem glutamatergik dan monoaminergik, namun mekanisme yang menyebabkan kelainan neurotransmitter ini tetap sulit dipahami. Kami meninjau hubungan antara autoimmunity dan gangguan neuropsikiatrik, dan bukti manusia dan eksperimental yang mendukung peran patogenik neuroinflamasi pada gangguan kejiwaan klasik terpilih. Memahami bagaimana sistem psikososial, genetik, imunologis dan neurotransmitter berinteraksi dapat mengungkapkan petunjuk patogen dan membantu menargetkan terapi pencegahan dan gejala baru.
Kata kunci:
- Neuroinflammation,
- Psikoneuroimunologi,
- Astrocyte,
- Microglia,
- Sitokin,
- Stres oksidatif,
- Depresi,
- Gangguan obsesif-kompulsif,
- Gangguan bipolar, skizofrenia
Konten
Pengantar
Karena kelainan biologis semakin teridentifikasi di antara pasien dengan gangguan kejiwaan, perbedaan antara penyakit neurologis dan psikiatri memudar. Selain penyakit autoimun sistemik yang terkait dengan manifestasi psikiatri (misalnya lupus) [1], baru-baru ini, pasien dengan psikosis akut terisolasi diidentifikasi dengan ensefalitim autoimun sinaptik (1-2). Pasien-pasien ini sering keliru didiagnosis dengan gangguan psikologi primer refrakter, menunda inisiasi terapi kekebalan yang efektif (Tabel 6). Selain itu, bukti yang berkembang mendukung peran patogen antibodi anti-neuronal pada gangguan neuropsikiatri [1].
Pemisahan gangguan neurologis dan kejiwaan, didukung oleh konsepsi Descartes tentang 'pikiran' sebagai entitas yang berbeda secara ontologis dan oleh reproduktifitas kelainan neuropatologis, mendominasi pengobatan di19th dan awal 20th century [8]. Sejak itu, kumpulan penyebab biologis yang dapat direproduksi, mulai dari neurosifilis, trauma kepala, stroke, tumor, pelonggaran dan banyak lainnya menyebabkan kompleks gejala yang tumpang tindih dengan gangguan kejiwaan klasik [9-11]. Baru-baru ini, kelainan neuroinflammatory dan imunologis telah didokumentasikan pada pasien dengan gangguan kejiwaan klasik.
Modulator imun perifer dapat menginduksi gejala kejiwaan pada model hewan dan manusia [12-19]. Hewan sehat yang disuntik dengan pro-inflamasi IL-1? dan tumor necrosis factor alpha (TNF-?) sitokin menunjukkan 'perilaku sakit' terkait dengan penarikan sosial [12]. Pada manusia, suntikan endotoksin dosis rendah menonaktifkan striatum ventral, wilayah penting untuk pemrosesan hadiah, menghasilkan anhedonia gejala depresi yang melemahkan [14]. Kira-kira 45% pasien hepatitis C dan kanker yang tidak mengalami depresi diobati dengan IFN-? mengembangkan gejala depresi yang berhubungan dengan peningkatan kadar serum IL-6 [12,15,17,18].
Kondisi medis yang berhubungan dengan kelainan inflamasi dan imunologi kronis, termasuk obesitas, diabetes, keganasan, rheumatoid arthritis, dan multiple sclerosis, merupakan faktor risiko depresi dan gangguan bipolar [10,12,13,15,17,18]. Yang positif�korelasi antara kondisi medis dan penyakit kejiwaan ini menunjukkan adanya proses inflamasi yang meluas yang mempengaruhi otak di antara organ lain [10,19,20]. Sebuah studi berbasis populasi 30 menunjukkan bahwa memiliki a penyakit autoimun atau rawat inap untuk infeksi serius meningkatkan risiko pengembangan skizofrenia oleh 29% dan 60%, masing-masing [16]. Selanjutnya, virus herpes simpleks, Toxoplasma gondii, cytomegalovirus, dan influenza selama kehamilan meningkatkan risiko pengembangan skizofrenia [16].
Seluler perifer [21,22] (Tabel 2), dan kelainan imunologi humoral [13,21-23] lebih umum pada pasien psikiatri dibandingkan dengan kontrol yang sehat. Dalam kedua studi percontohan (n = 34 pasien dengan gangguan depresi mayor (MDD), n = 43 kontrol sehat) dan replikasi (n = 36 MDD, n = 43 kontrol sehat), uji serum yang terdiri dari sembilan biomarker serum membedakan subjek MDD dari yang sehat. kontrol dengan sensitivitas 91.7% dan spesifisitas 81.3%; biomarker yang meningkat secara signifikan untuk gejala neuropsikiatri adalah molekul imunologi antitripsin alfa 1, myeloperoksidase, dan TNF-? reseptor II [23].
 Kami pertama kali meninjau hubungan antara autoimmunity dan gangguan neuropsikiatrik, termasuk: 1) lupus eritematosus sistemik (SLE) sebagai prototipe penyakit auto-imun sistemik; 2) ensefalit autoimun yang terkait dengan autoantibodi serum anti-sinaptik dan glutamat asam (GAD); dan 3) gangguan autoimun neuropsikiatri anak yang terkait dengan infeksi streptokokus (PANDAS) dan gangguan obsesif-kompulsif murni (OCD) yang terkait dengan ganglia anti-basal / autoantibodi talamus. Kami kemudian membahas peran peradangan bawaan / autoimunitas pada gangguan kejiwaan klasik, termasuk MDD, gangguan bipolar (BPD), skizofrenia, dan OCD.
Kami pertama kali meninjau hubungan antara autoimmunity dan gangguan neuropsikiatrik, termasuk: 1) lupus eritematosus sistemik (SLE) sebagai prototipe penyakit auto-imun sistemik; 2) ensefalit autoimun yang terkait dengan autoantibodi serum anti-sinaptik dan glutamat asam (GAD); dan 3) gangguan autoimun neuropsikiatri anak yang terkait dengan infeksi streptokokus (PANDAS) dan gangguan obsesif-kompulsif murni (OCD) yang terkait dengan ganglia anti-basal / autoantibodi talamus. Kami kemudian membahas peran peradangan bawaan / autoimunitas pada gangguan kejiwaan klasik, termasuk MDD, gangguan bipolar (BPD), skizofrenia, dan OCD.
Gangguan Neuropsikiatrik Terkait dengan Autoimunitas
Systemic Lupus Erythematosus
Antara 25% hingga 75% pasien SLE memiliki keterlibatan sistem saraf pusat (SSP), dengan gejala psikiatrik biasanya terjadi dalam dua tahun pertama onset penyakit. Gejala kejiwaan mungkin termasuk kecemasan, suasana hati dan gangguan psikotik [97]. Pencitraan resonansi magnetik otak (MRI) normal pada sekitar 42% kasus SLE neuropsikiatri [97]. Kerusakan mikroangiopati dan sawar darah otak (BBB) dapat menyebabkan masuknya autoantibodi ke dalam otak [97]. Antibodi ini termasuk anti-ribosomal P (positif pada 90% pasien SLE psikotik) [1], sel anti-endotel, anti-ganglioside, anti-dsDNA, subunit anti-2A/2B dari reseptor N-metil-D-aspartat ( NMDAR) dan antibodi anti-fosfolipid [97]. Sitokin pro-inflamasi terutama IL-6 [97], S100B�[97], molekul adhesi intra-seluler 1 [97] dan matrix-metalloproteinase-9 [98] juga meningkat pada SLE. Manifestasi psikiatri SLE, penyakit Sjogren, sindrom Susac, vaskulitis SSP, penyakit CNS Whipple, dan penyakit Behc'et baru-baru ini ditinjau [1].
Ensefalitida Autoimun Neuropsikiatri Yang Berhubungan Dengan Serum Anti-Sinaptik & Asam Glutamat Dekarboksilase
Autoantibodi
Ensefalitida autoimun ditandai dengan onset akut kejang lobus temporal, gambaran psikiatri, dan defisit kognitif [2,3,99-108]. Patofisiologi biasanya dimediasi oleh autoantibodi yang menargetkan autoantigen sinaptik atau intraseluler dalam kaitannya dengan plastik paraneo atau asal nonparaneoplastik [3]. Autoantibodi anti-sinaptik menargetkan subunit NR1 dari NMDAR [100,108,109], kompleks saluran kalium dengan gerbang tegangan (VGKC) (subunit Kv1, glioma kaya leusin yang tidak aktif (LGI1) dan protein terkait kontak 2 (CASPR2)) [101,102,106], GluR1 dan GluR2 subunit dari amino-3- hidroksi-5-metil-l-4-reseptor asam isoxazolepropionic (AMPAR) [6,110,111] dan subunit B1 dari? -Aminobutirat asam B reseptor (GABABR) [3,99,103]. Autoantibodi anti-intraseluler menargetkan onconeuronal dan autoantigen GAD-65 [2,3].
Peradangan yang terkait dengan autoantibodi anti-sinaptik, terutama NMDAR-autoantibodi, biasanya jauh lebih ringan daripada yang terkait dengan autoantibodi GAD atau autoantibodi anti-neuronal yang terkait dengan gangguan auto-imun sistemik atau sindrom paraneoplastik [2,107].
Meskipun gejala neurologis akhirnya muncul, manifestasi kejiwaan, mulai dari kecemasan [2,3] hingga psikosis meniru skizofrenia [2-6], awalnya dapat mendominasi atau mendahului fitur neurologis. Sampai dua pertiga pasien dengan ensefalitis autoimun anti-NMDAR, awalnya hadir untuk layanan psikiatri [5]. Anti-sinapsis antibodi-mediated autoimun encephalitides harus dipertimbangkan dalam diferensial psikosis akut [2-6]. Presentasi psikiatri dapat mencakup laboratorium MRI otak normal dan cairan serebrospinal (CSF), tanpa ensefalopati atau kejang [2,3,5,6,107]. Kami melaporkan kasus autoantibodi GAD seropositif yang terkait dengan neuroinflamasi yang telah terbukti dengan biopsi, terlepas dari analisis MRI dan CSF otak normal, di mana pasien menjalani psikosis terisolasi yang didiagnosis skizofrenia dengan Manual Diagnostik dan Statistik Mental Disorders, kriteria 4th Edition (DSM-IV) [2]. Selanjutnya, ensefalitir autoimun seronegatif juga dapat hadir dengan gangguan neuropsikiatrik yang menonjol, membuat diagnosis lebih sulit dipahami [107,112,113]. Gambaran psikiatri dan neurologis yang terkait dengan autoantibodi anti-sinaptik dan sinapsis dirangkum dalam Tabel 1 [1-6,99-108,114].
Serum anti-sinaptik dan autoantibodi GAD dapat terjadi pada pasien dengan gangguan kejiwaan murni [2,4,5,112,115-121]. Dalam kohort prospektif dari 29 subjek yang memenuhi kriteria DSM-IV untuk skizofrenia, autoantibodi anti-NMDAR serum ditemukan pada tiga subjek, dan autoantibodi anti-VGKC kompleks ditemukan pada satu subjek [5]. Menggunakan teknik yang lebih sensitif untuk mendeteksi autoantibodi immunoglobulin G (IgG) NR1 pada 100 pasien dengan skizofrenia tertentu, tidak ada autoantibodi yang teridentifikasi [122]. Namun, penelitian ini tidak menilai autoantibodi yang menargetkan subunit NR2 dari NMDAR. Penelitian lain melaporkan secara signifikan peningkatan kemungkinan peningkatan (tingkat kontrol non-psikiatri persentil ke-90) tingkat antibodi NR2 (rasio odds (OR) 2.78, interval kepercayaan 95% (CI) 1.26 hingga 6.14, P = 0.012) di antara individu dengan mania akut ( n = 43), tetapi tidak pada mania kronis atau skizofrenia [116].
PANDAS & Gangguan Obsesif-Kompulsif Murni Terkait Dengan Ganglia Anti-Basal / Talamik Autoantibodi
OCD sering memperumit gangguan neurologis yang melibatkan ganglia basal termasuk chorea Sydenham, penyakit Huntington, dan penyakit Parkinson. Antibodi ganglia antibasal terlibat dalam chorea Sydenham [123]. PANDAS ditandai dengan eksaserbasi akut gejala OCD dan/atau tics motorik/fonik setelah infeksi streptokokus hemolitik grup A prodromal. Patofisiologi dianggap melibatkan reaktivitas silang antara antibodi anti-streptokokus dan protein ganglia basal [124]. Tumpang tindih klinis antara PANDAS dan OCD murni menunjukkan mekanisme etiologi umum [125].
Di antara kohort acak dari 21 pasien OCD murni, 91.3% memiliki CSF anti-basal ganglia (P <0.05) dan autoantibodi anti-thalamic (P <0.005) pada 43 kDa [88], paralel dengan kelainan fungsional pada cortico-striatal-thalamo sirkuit -cortico subjek OCD [84]. Studi lain mendokumentasikan bahwa 42% (n = 21) subjek anak-anak dan remaja OCD memiliki autoantibodi anti-basal ganglia serum pada 40, 45, dan 60 kDa dibandingkan dengan 2% sampai 10% dari kontrol (P = 0.001) [7]. Autoantibodi ganglia antibasal terdeteksi dalam serum 64% subjek PANDAS (n = 14), dibandingkan dengan hanya 9% (n = 2) dari kontrol streptokokus-positif/OCD-negatif (P <0.001) [126]. Satu studi tidak menemukan perbedaan antara prevalensi autoantibodi ganglia anti-basal pada OCD (5.4%, n = 4) versus kontrol MDD (0%) [127]; namun, batasannya adalah penggunaan acak korteks tikus dan ganglia basal sapi dan korteks yang mungkin membatasi identifikasi kasus seropositif.
Autoantigen basal ganglia adalah aldolase C (40 kDa), enolase neuronal-spesifik/non-neuronal (45 kDa doublet) dan piruvat kinase M1 (60 kDa)-enzim glikolitik neuronal-yang terlibat dalam neurotransmisi, metabolisme neuronal
Halaman 3 dari 24 dan pensinyalan sel [128]. Enzim ini menunjukkan homologi struktural substansial untuk protein streptokokus [129]. Studi terbaru (96 OCD, 33 MDD, 17 subjek skizofrenia) menguji serum pasien terhadap piruvat kinase, aldolase C dan enolase, khususnya; proporsi yang lebih besar dari subyek OCD adalah sero-positif relatif terhadap kontrol (19.8% (n = 19) versus 4% [n = 2], P = 0.012) [130].
Namun, dalam penelitian yang sama hanya satu dari subyek positif ON 19 sero-positif juga memiliki antibodi anti-streptolysin O positif, yang menunjukkan bahwa pada OCD murni, seronegativitas antibodi anti-streptolysin O tidak menyingkirkan adanya autoantibodi ganglia anti-basal. .
Pada OCD murni, sero-positivity untuk antibodi ganglia / thalamic anti-basal dikaitkan dengan peningkatan kadar glisin CSF (P = 0.03) [88], yang menunjukkan bahwa zat anti-bodi ini berkontribusi terhadap hyperglutamatergia yang diamati pada OCD [84,88,131]. Perbaikan OCD yang dipicu infeksi dengan terapi kekebalan mendukung patogenisitas autoantibodi ini [132]. Uji coba NIH yang besar yang menilai keefektifan imunoglobulin intravena (IVIG) untuk anak-anak dengan onset akut OCD dan antibodi anti-streptokokus sedang berlangsung (ClinicalTrials.gov: NCT01281969). Namun, temuan kadar glutamat CSF yang sedikit lebih tinggi pada pasien OCD dengan ganglia anti-basalis negatif CSF / antikanker thalamik dibandingkan dengan antibodi CSF positif menunjukkan bahwa mekanisme non-imunologis dapat berperan dalam OCD [84]. Mekanisme lain, termasuk peradangan yang dimediasi sitokin (Tabel 2), juga dihipotesiskan.
Gangguan Psikiatri Terkait dengan Peradangan Baidu
Gangguan peradangan/autoimunitas bawaan terjadi pada beberapa pasien dengan gangguan kejiwaan klasik. Kami membahas kelainan SSP terkait peradangan bawaan termasuk patologi glial, peningkatan kadar sitokin, aktivasi siklo-oksigenase, disregulasi glutamat, peningkatan kadar S100B, peningkatan stres oksidatif, dan disfungsi BBB pada MDD, BPD, skizofrenia, dan OCD. Kami juga menjelaskan bagaimana peradangan bawaan dapat secara mekanis terkait dengan kelainan monoaminergik dan glutamatergik tradisional yang dilaporkan pada gangguan ini (Gambar 1 dan 2). Peran terapeutik agen antiinflamasi pada gangguan kejiwaan juga ditinjau.
 Histopatologi Astroglial & Oligodendroglial
Histopatologi Astroglial & Oligodendroglial
Astroglia dan oligodendroglia sangat penting untuk saraf metabolik homeostasis, perilaku dan fungsi kognitif yang lebih tinggi [54-56,133-136]. Astroglia diam normal memberikan energi dan dukungan trofik untuk neuron, mengatur transmisi saraf sinaptik (Gambar 2), sinaptogenesis, aliran darah serebral, dan mempertahankan integritas BBB [134,136,137]. Oligodendroglia dewasa memberikan energi dan dukungan trofik ke neuron dan menjaga integritas BBB, dan mengatur perbaikan aksonal�dan myelination dari saluran materi putih yang menyediakan konektivitas antar dan intra-hemispheric [54-56]. Baik astroglia dan oligodendroglia menghasilkan sitokin anti-inflamasi yang dapat menurunkan-mengatur peradangan berbahaya [52,55].
Di MDD, kehilangan astroglial adalah temuan post-mortem yang konsisten di area yang relevan secara fungsional, termasuk korteks cingulate anterior, korteks prefrontal, amigdala, dan materi putih [35-38,42-46,55,138-147], dengan sedikit pengecualian [42,43]. Studi post-mortem menunjukkan peningkatan protein asam glial fibrillary acidic (GFAP) - kerapatan astroglial positif terutama pada korteks prefrontal [37,38] dan amigdala [36]. Analisis proteomik besar korteks frontal dari pasien depresi menunjukkan penurunan yang signifikan pada tiga isoform GFAP [39]. Meskipun dalam satu penelitian yang melaporkan tidak ada kerugian glial yang signifikan, analisis subkelompok menunjukkan penurunan yang signifikan (75%) pada kepadatan astroglial GFAP-positif di antara subjek penelitian yang berusia di bawah 45 tahun [35]. Sebuah studi morfometrik sama sekali tidak menunjukkan adanya perubahan kerapatan glial pada otak MDD akhir-akhir [148]. Kami berhipotesis bahwa ketidakhadiran hilangnya astroglial di antara pasien MDD yang lebih tua mungkin mencerminkan astrogliosis sekunder [35] yang dikaitkan dengan usia yang lebih tua [42,50] dan bukan negatif sejati.
Penelitian pada hewan konsisten dengan penelitian pada manusia yang menunjukkan hilangnya astroglial pada MDD. Tikus Wistar-Kyoto yang diketahui menunjukkan perilaku seperti depresi menunjukkan penurunan kepadatan astroglial di area yang sama seperti yang diamati pada manusia [40]. Pemberian agen beracun astroglial, asam L-alpha-aminoadipic, menginduksi gejala seperti depresi pada tikus, menunjukkan bahwa kehilangan astroglial bersifat patogen pada MDD [41].
Penelitian post-mortem subjek MDD yang didokumentasikan mengurangi kepadatan oligodendroglial pada korteks prefrontal dan amigdala [54-57,66], yang dapat berkorelasi dengan perubahan materi putih fokal otak MRI yang kadang-kadang dicatat pada beberapa pasien MDD [57]. Namun, kelainan mikrovaskular juga dapat menyebabkan perubahan ini [57].
Di BPD, beberapa penelitian menunjukkan kerugian glial yang signifikan [138,143,149,150], sementara yang lainnya tidak [37,44-46]. Temuan yang tidak konsisten ini mungkin diakibatkan oleh kurangnya kontrol untuk: 1) dengan stabilisator suasana hati, karena analisis post-hoc yang dilaporkan oleh beberapa penelitian menunjukkan pengurangan kerugian glial yang signifikan hanya setelah mengendalikan pengobatan dengan asam lithium dan valproic [46]; 2) bentuk keluarga BPD, karena kerugian glial sangat menonjol di antara pasien BPD dengan riwayat keluarga yang kuat [143]; dan / atau, 3) keadaan predominan depresi versus mania, karena kehilangan glial sering terjadi pada MDD [35-38,42-46,55,138-147]. Apakah astroglia atau oligodendroglia menyebabkan sebagian besar kerugian glial tidak jelas; sementara analisis proteomik menunjukkan penurunan yang signifikan dalam satu isoform GFAP astroglial [39], beberapa penelitian post-mortem lainnya menemukan XXUMX yang tidak berubah atau mengurangi ekspresi astroglial GFAP-positif di korteks orbitrofrontal [36,37], atau mengurangi kepadatan oligodendroglial [47- 54].
Pada skizofrenia, kehilangan astroglial adalah temuan yang tidak konsisten [48,150]. Sementara beberapa penelitian menunjukkan tidak ada kerugian astroglial yang signifikan [42,50,51], beberapa lainnya menemukan penurunan kepadatan astroglial [37,38,43,44,48,49,151] dan pengurangan yang signifikan pada dua isoform GFAP [39]. Temuan yang tidak konsisten dapat terjadi akibat: 1) komorbiditas MDD, yang sering dikaitkan dengan hilangnya glial; 2), karena pasien yang lebih tua mengalami peningkatan astroglia positif GFAP; 35,42,50; 3) regional [150] dan variabilitas lapisan kortikal [48]; 4) dengan obat antipsikotik, karena penelitian eksperimental menunjukkan penurunan [152] dan peningkatan kepadatan astroglial [153] yang terkait dengan pengobatan antipsikotik kronis [70]; dan 5) penyakit negara (misalnya, perilaku bunuh diri versus non-bunuh diri) [154]. Penelitian post-mortem mendokumentasikan kehilangan oligodendroglial [54,56,60-65,148,155,156], terutama di korteks prefrontal, korteks anterior cingulate, dan hippocampus [148]. Pemeriksaan ultrastruktural daerah prefrontal menunjukkan serat myelinated yang tidak normal baik pada materi abu-abu maupun putih; Usia dan durasi penyakit berkorelasi positif dengan kelainan materi putih [157].
Berbeda dengan gangguan neurodegeneratif yang umumnya terkait dengan proliferasi astroglial [136], gangguan kejiwaan malah terkait dengan kerapatan astroglial yang berkurang atau tidak berubah [138]. Kurangnya peningkatan kepadatan glial pada gangguan kejiwaan dini [44,138] mungkin mencerminkan laju perkembangan degeneratif yang lebih lambat pada penyakit kejiwaan [138].
Kami mendalilkan bahwa perubahan degeneratif yang terkait dengan gangguan kejiwaan lebih halus dan tidak cukup parah untuk memicu faktor transkripsi intraseluler astroglial yang secara positif mengatur astrogliosis, termasuk aktivator transduser sinyal dari transkripsi 3 dan faktor nuklir kappa B (NF-? B) [136].
Sementara sebagian besar penelitian post-mortem berfokus pada perubahan kerapatan glial pada MDD, BPD, dan skizofrenia, beberapa lainnya menggambarkan perubahan morfologi sel glial, dengan temuan beragam. Di MDD dan BPD, ukuran glial meningkat atau tidak berubah [55]. Satu studi menemukan penurunan ukuran glial pada BPD dan skizofrenia namun tidak pada MDD [43]. Penelitian post-mortem terhadap pasien depresi yang melakukan bunuh diri menemukan peningkatan ukuran astroglial pada benda putih cingulate anterior namun tidak di korteks [158]. Satu studi pada subyek skizofrenia menemukan penurunan ukuran astroglial pada lapisan V dari korteks prefrontal dorsolateral, meskipun kepadatan astroglial dua kali lipat dari kontrol pada lapisan yang sama [48]. Hasil campuran sebagian dapat mencerminkan studi awal tentang perubahan glial pada penyakit kejiwaan yang tidak menentukan astroglia versus oligodendroglia [148].
Kehilangan glial pada penyakit psikiatrik dapat menyebabkan peradangan saraf melalui beberapa mekanisme, termasuk kadar sitokin yang abnormal (lihat bagian Sitokin), metabolisme glutamat yang tidak teratur (lihat bagian Glutamat), peningkatan protein S100B (lihat bagian S100B),�dan mengubah fungsi BBB (lihat bagian penghalang otak Darah), yang mengakibatkan gangguan kognisi dan perilaku [44,45,54,133,159].
Histopatologi mikroglial
Microglia adalah sel kekebalan penduduk dari SSP. Mereka menyediakan surveilans kekebalan yang berkelanjutan dan mengatur pemangkasan sinaps perkembangan [160,161]. Cedera CNS mengubah mikroglia peristirahatan yang tertekan menjadi sel amoeboid fagositik berbentuk batang dan makrofag yang memanjang, yang berkembang biak dan bermigrasi ke lokasi luka di sepanjang gradien chemotactic (yaitu aktivasi dan proliferasi mikroba (MAP)) [161]. Sel mikroglial manusia mengekspresikan NMDAR yang dapat memediasi MAP yang menyebabkan cedera neuron [162].
Di MDD, BPD dan skizofrenia, hasil studi post-mortem yang menyelidiki adanya MAP beragam. Studi post-mortem menunjukkan peningkatan MAP hanya dalam satu dari lima subyek MDD [67]. Pada beberapa pasien gangguan BPD, peningkatan antigen leukosit manusia-DR-positif microglia yang menampilkan proses menebal didokumentasikan di korteks frontal [69]. Dalam skizofrenia, sementara beberapa penelitian melaporkan peningkatan MAP relatif terhadap kontrol, yang lain tidak menunjukkan perbedaan antara kelompok [22,67,70]. Dalam studi post-mortem yang menilai MAP di MDD dan BPD; kerapatan sel mikroglial kuinolinat asam positif meningkat di korteks anterior cingulate anterior dan korteks anterior midcingulate pasien MDD dan BPD yang melakukan bunuh diri relatif terhadap kontrol [53]. Analisis pasca-hoc menunjukkan bahwa peningkatan MAP ini hanya disebabkan oleh MDD dan bukan BPD, karena pewarnaan immuno microglial positif pada subyek MDD secara signifikan lebih besar daripada pada sub kelompok BPD baik pada korteks anterior sentral dan korteks midatulate subgenual, dan karena kepadatan mikroglia serupa pada kelompok BPD dan kontrol [53]. Sebuah studi yang membandingkan ketiga gangguan (sembilan MDD, lima BPD, empat belas skizofrenia, sepuluh kontrol sehat) tidak menunjukkan perbedaan yang signifikan dalam kepadatan mikroglial pada keempat kelompok [68].
Hasil campuran ini dapat dikaitkan dengan penanda imunologi mikroglial variabel yang digunakan di antara berbagai studi [70] dan / atau kegagalan untuk mengendalikan tingkat keparahan penyakit [22,53,68]. Khususnya, tiga studi post-mortem MDD dan subjek skizofrenia mendokumentasikan korelasi positif yang kuat antara MAP dan suicidality di korteks cingulate anterior dan thalamus mediodorsal, tergantung diagnosis psikiatri [22,53,68]. Dengan demikian, MAP mungkin merupakan keadaan daripada tanda sifat untuk MDD dan skizofrenia.
Dalam OCD, model hewan menunjukkan bahwa disfungsi dan pengurangan fenotip mikroglial tertentu, seperti yang mengekspresikan gen Hoxb8, yang mengkodekan faktor homeobox transkripsi, dapat menyebabkan perilaku seperti OCD [71,72].
Tikus knockout HoxbXNXX menunjukkan perilaku dan kecemasan yang berlebihan dalam hubungannya dengan kepadatan mikroglial yang berkurang [8]. Perilaku perawatan yang berlebihan ini menyerupai karakteristik perilaku OCD manusia. Injeksi Hoxb71,72 pada tikus KO Hoxb8 dewasa membalikkan kerugian mikroglial dan mengembalikan perilaku normal [8]. Peran fenotipe mikroglial spesifik ini dalam OCD manusia tidak jelas.
Data eksperimental menunjukkan bahwa MAP terdiri dari fenotipe berbahaya dan neuroprotektif yang berbeda (Gambar 2). Mikroglia yang berbahaya tidak menunjukkan kompleks histokompatibilitas kompleks II (MHC-II) dan oleh karena itu, tidak dapat bertindak sebagai antigen presenting cells (APC) [163,164]; mereka mempromosikan efek merugikan [17,69,165] melalui produksi sitokin proinflamasi, pensinyalan nitrat oksida sintase [17,166], mempromosikan ekspresi glial dan BBB-pericyte / endothelial cyclooxygenase- 2 (COX-2) [167], menginduksi sekresi S100B astrogli (lihat bagian S100B) , dan pelepasan glutamat mikroglial [17,136,168,169]. Microglia yang berbahaya juga mensekresikan prostaglandin E-2 (PGE-2) yang mempromosikan produksi sitokin proinflamasi, yang pada gilirannya meningkatkan tingkat PGE-2 dalam siklus umpan maju [29]. Selanjutnya, PGE-2 menstimulasi ekspresi COX-2, yang menengahi konversi asam arakidonat ke PGE-2, menyiapkan siklus umpan maju lainnya [29].
Mikroglia neuroprotective sebaliknya dapat: 1) mengekspresikan MHC-II secara in vivo dan in vitro [163,166] dan bertindak sebagai APC serumpun (Gambar 2) [163,164,166]; 2) memfasilitasi penyembuhan dan membatasi cedera neuron dengan mempromosikan sekresi sitokin antiinflamasi [17], faktor neurotropik yang diturunkan dari otak [17], dan faktor pertumbuhan mirip insulin-1 [166]; dan 3) mengekspresikan pengatur asam amino rangsang-2 (EAAT2) yang menghilangkan kelebihan glutamat ekstraseluler [163,166], dan mempromosikan autoimunitas limfosfat T neuroprotektif (Gambar 2) [163,164]. Namun, penelitian lebih lanjut diperlukan untuk mengkonfirmasi peran kontributor mikroglia neuroprotektif terhadap gangguan neuropsikiatri pada manusia.
Secara in vitro penelitian pada hewan menunjukkan bahwa rasio mikroglia berbahaya versus neuroprotektif dapat dipengaruhi oleh efek bersih dari mekanisme kontra-regulasi inflamasi [15,74,164,166]. Mekanisme ini termasuk jumlah sel pengatur CD4 + CD25 + FOXP3 + T pelindung saraf ((T regs) Gambar 1) [15,74,164,166] dan tingkat sitokin otak; IFN- rendah? tingkat dapat mempromosikan mikroglia pelindung saraf (Gambar 2) [166], sedangkan tingkat tinggi dapat mempromosikan fenotipe berbahaya [166].
Peran sitokin
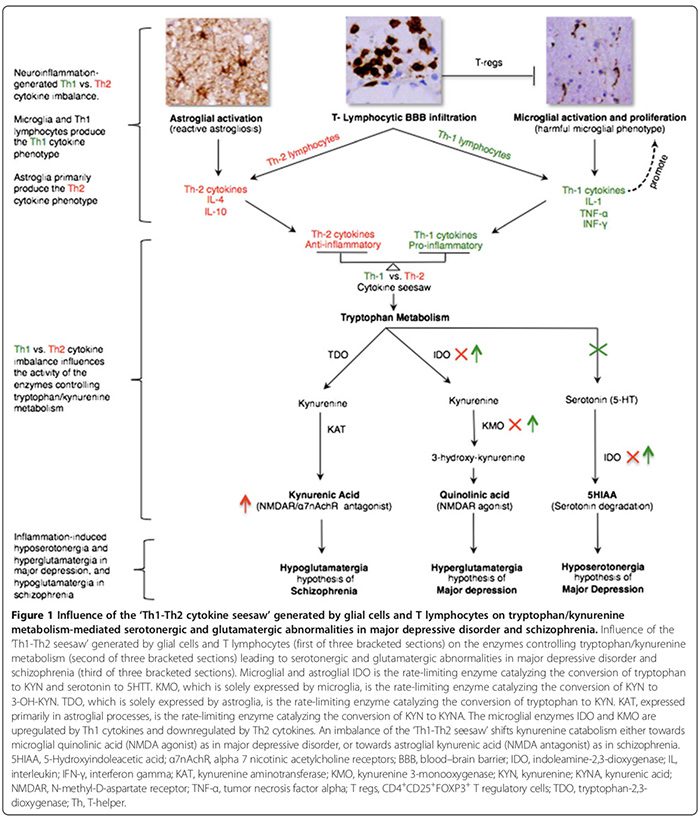
Sitokin proinflamasi termasuk IL-1?, IL-2, IL-6, TNF-? dan IFN-?. Mereka disekresikan terutama oleh mikroglia, limfosit Th1 dan monosit/makrofag fenotip M1 (Gambar 1) [15,170]. Mereka mempromosikan peradangan berbahaya. Sitokin antiinflamasi termasuk IL-4, IL-5 dan IL-10. Mereka terutama disekresikan oleh astroglia,�Limfosit Th2, T regs dan M2 fenotipe monosit / makrofag [15,52,74]. Mereka dapat membatasi peradangan yang berbahaya [15,74] dengan mengubah tipe M1-proinflammatory menjadi fimotipe M2 antiinflammatory yang menguntungkan [15], dan berpotensi dengan mempromosikan fenotipe mikrogliens neuroprotektif [15,17,74,163,166]. Peran sitokin proinflammatory / antiinflamasi pada psikiatri dis- order didukung oleh beberapa bukti (Gambar 1, Tabel 2) [15,17,29,52,74].
Pada MDD, meta-analisis terbaru (29 penelitian, 822 MDD, 726 kontrol sehat) dari sitokin proinflamasi serum menegaskan bahwa reseptor IL-2 yang dapat larut, IL-6 dan TNF-? tingkat meningkat pada MDD (penanda sifat) [91], sedangkan, IL-1 ?, IL-2, IL-4, IL-8 dan IL-10, secara statistik tidak berbeda dari kontrol [91]. Dalam studi sitokin primer yang membandingkan subkelompok MDD (47 MDD bunuh diri, 17 MDD non-bunuh diri, 16 kontrol kesehatan), baik serum IL-6 dan TNF-? secara signifikan lebih tinggi, sementara tingkat IL-2 secara signifikan lebih rendah pada subjek MDD yang melakukan bunuh diri dibandingkan dengan kedua kelompok lain [96]. Temuan ini menunjukkan bahwa IL-6 dan TNF-? juga merupakan penanda negara bagian MDD [96]. Penurunan kadar IL-2 serum yang terkait dengan perilaku bunuh diri akut mungkin mencerminkan peningkatan pengikatan pada reseptor yang diatur di otak; paralel dengan meta-analisis yang menunjukkan peningkatan reseptor IL-2 terlarut di MDD [91]. Studi yang menyelidiki signifikansi klinis sitokin dalam MDD menunjukkan bahwa kadar sitokin serum meningkat selama episode depresi akut [171,172] dan dinormalisasi setelah berhasil, tetapi tidak gagal, pengobatan dengan antidepresan [17] dan terapi kejang elektro [29]; temuan ini menunjukkan kemungkinan peran patogenik untuk sitokin.
Pada BPD, perubahan sitokin serum dirangkum dalam ulasan terbaru; TNF- ?, IL-6 dan IL-8 meningkat selama fase manik dan depresi, sedangkan IL-2, IL-4 dan IL-6 meningkat selama mania [92]. Penelitian lain menunjukkan bahwa serum IL-1? dan tingkat reseptor IL-1 secara statistik tidak berbeda dari kontrol yang sehat [92], meskipun penelitian jaringan mendokumentasikan peningkatan kadar IL-1? dan reseptor IL-1 di korteks frontal BPD [69].
Pada skizofrenia, hasil dari penelitian yang menyelidiki kelainan sitokin saling bertentangan (Tabel 2). Sementara beberapa penelitian menemukan penurunan proinflamasi serum (IL-2, IFN-?) dan peningkatan sitokin antiinflamasi serum dan CSF (IL-10) [52], yang lain menemukan peningkatan sitokin pro dan antiinflamasi serum, dengan dominasi tipe proinflamasi [22,173,174 ]. Satu meta-analisis sitokin (62 studi, 2,298 skizofrenia, 858 kontrol sehat) menunjukkan peningkatan level antagonis IL-1R, sIL-2R dan IL-6 [174]. Namun, penelitian ini tidak memperhitungkan penggunaan antipsikotik, yang diduga meningkatkan produksi sitokin proinflamasi [52]. Meta-analisis sitokin yang lebih baru (40 penelitian, 2,572 penderita skizofrenia,�4,401 kontrol) yang memperhitungkan antipsikotik, menemukan bahwa TNF- ?, IFN- ?, IL-12 dan sIL-2R secara konsisten meningkat pada skizofrenia kronis yang tidak bergantung pada aktivitas penyakit (penanda sifat), sementara IL-1 ?, IL-6 dan mengubah faktor pertumbuhan beta berkorelasi positif dengan aktivitas penyakit (penanda negara) [173]. Kultur sel sel mononuklear darah tepi (PBMC) yang diperoleh dari pasien skizofrenia menghasilkan tingkat IL-8 dan IL-1 yang lebih tinggi? secara spontan serta setelah stimulasi oleh LPS, menunjukkan peran monosit / makrofag yang diaktifkan dalam patologi skizofrenia [175].
Pada OCD, hasil dari survei acak sitokin serum dan CSF, dan studi PBMC yang distimulasi LPS, tidak konsisten [93-95,176-179]. Ada korelasi antara OCD dan polimorfisme fungsional di wilayah promotor TNF-? gen [34], meskipun penelitian bertenaga rendah tidak mengkonfirmasi hubungan ini [180]. Oleh karena itu, hasil campuran dari studi yang mendokumentasikan peningkatan atau penurunan TNF-? tingkat sitokin [93,176-178] mungkin mencerminkan variabel inklusi subset subjek OCD dengan polimorfisme khusus ini dalam kelompok mereka.
Polarisasi Respon Sitokin Pada Depresi & Skizofrenia Mayor
Fenotipe respons sitokin diklasifikasikan sebagai Th1 proinflamasi (IL-2, IFN-?) atau Th2 antiinflamasi (IL-4, IL-5, IL-10) sesuai dengan fungsi kekebalan yang mereka atur. Sementara sitokin Th1 mengatur imunitas seluler yang diarahkan melawan antigen intraseluler, sitokin Th2 mengatur imunitas humoral yang diarahkan melawan antigen ekstraseluler [29,52]. Sitokin Th1 diproduksi oleh limfosit Th1 dan monosit M1 sedangkan sitokin Th2 diproduksi oleh limfosit Th2 dan monosit M2 [29,52]. Di otak, mikroglia terutama mensekresi sitokin Th1, sedangkan astroglia dominan mensekresi sitokin Th2 [29,52]. Rasio timbal balik sitokin Th1:Th2, selanjutnya �Th1-Th2 jungkat-jungkit,� dipengaruhi oleh proporsi mikroglia teraktivasi (kelebihan Th1) menjadi astroglia (kelebihan Th2) dan interaksi antara sel T teraktivasi dan kadar glutamat SSP berlebihan yang kami hipotesiskan untuk mendukung respons Th1 (Gambar 2) [29,163,166].
Ketidakseimbangan imbas Th1-Th2 dapat mempengaruhi metabolisme triptofan dengan mengubah enzimnya [21,52] sehingga mengubah katabolisme triptofan menjadi kohorenin (KYN) dan katabolisme KYN terhadap salah satu dari dua metabolit hilirnya; asam quinolinic microglia yaitu asam kynurenic dimediasi atau astroglial kynurenic acid (KYNA) (1) yang dimediasi oleh Th1 [2].
Enzim metabolisme triptofan yang dipengaruhi oleh jungkat-jungkit Th1-Th2 meliputi (Gambar 1): indoleamin 2,3-dioksigenase (IDO) yang diekspresikan oleh mikroglia dan astroglia, enzim pembatas laju yang memediasi konversi triptofan menjadi KYN dan serotonin menjadi 5- asam hidroksiindoleasetat�[21,29]. Kynurenine 3-monooxygenase (KMO), hanya diekspresikan oleh mikroglia, adalah enzim pembatas laju yang mengubah KYN menjadi 3-hydroxykynurenine (3-OH-KYN), yang selanjutnya dimetabolisme menjadi asam quinolinic [21,29]. Tryptophan-2,3-dioxygenase (TDO), diekspresikan hanya oleh astroglia, adalah enzim pembatas laju yang mengubahtriptofan ke KYN [21,29]. Kynurenine aminotransferase (KAT), yang dinyatakan terutama dalam proses astroglial, adalah enzim pembatas laju yang menengahi konversi KYN menjadi KYNA [21,29].
Sitokin Th1 mengaktifkan mikroglial IDO dan KMO, menggeser katabolisme mikroglial KYN menuju quinolinic�asam (NMDAR agonist), sementara sitokin Th2 mengaktifkan IDO mikroklinis dan KMO, mengubah katabolisme KYN astroglial menuju sintesis KYNA (NMDAR antagonis) yang dimediasi TDO dan KAT (Gambar 1) [21,29].
Imunofenotipe predominan Th1 dan Th2 telah diusulkan untuk MDD dan skizofrenia, masing-masing, berdasarkan pola sitokin perifer, bukan SSP [52,173]. Kami percaya bahwa pola sitokin perifer adalah penanda pengganti yang tidak dapat diandalkan dari yang ada di SSP. Memang, kadar sitokin perifer dapat dipengaruhi oleh banyak variabel ekstra-SSP, yang tidak dikontrol secara konsisten dalam beberapa studi sitokin perifer, termasuk: 1) usia, indeks massa tubuh, pengobatan psikotropika, merokok, stres, dan fluktuasi sirkadian; 2) pengaruh�aktivitas penyakit / keadaan pada produksi sintesis sitokin yang dipilih [95,173]; dan 3) efek agen psikotropika pada produksi sitokin [52]. Waktu paruh yang pendek dan pergantian cepat sitokin serum [181] (misalnya, 18 menit untuk TNF-? [182] versus 60 menit untuk IL-10 [183]), selanjutnya dapat membatasi keandalan interpretasi mereka. tingkat yang diukur dari sampel sera acak.
Dalam MDD, ada konsensus bahwa respon immunophenotype Th1 proinflamasi mendominasi (Tabel 2) [17,29]. Tingkat asam quinolinic yang tinggi pada otak MDD post-mortem [53], menunjukkan adanya respon Th1 yang diregulasi (Gambar 1) [21,29]. Peningkatan asam quinolinic SSP dapat mempromosikan masuknya kalsium dimediasi apoptosis astroglia manusia [184], yang secara hipotetis dapat menumpulkanTanggapan Th2 yang diturunkan dari astroglia [29], memberi tip Th1 versus Th2 terhadap keseimbangan respons ThxNUMX mikroglial. Singkatan CNS hyposerotonergia [1] menambahkan dukungan lebih lanjut terhadap respons Th29 berlebih, yang terbukti mengurangi sintesis serotonin SSP [1] dan untuk meningkatkan degradasinya (Gambar 185) [1].
Hyperglutamatergia CNS juga dapat menyebabkan respons Th1 berlebih di otak (Gambar 2). Sebuah studi in vitro menunjukkan bahwa limfosit T yang resisten perifer secara konstitutif mengekspresikan reseptor glutamat metabotropik 5 (mGluR5) [164], yang mengikat glutamat menghambat pelepasan IL-6 limfositik, sehingga menurunkan proliferasi sel T-efektor auto-reaktif [164]. Limfosit T yang diaktivasi, namun tidak terletak pada limfosit T, dapat melewati BBB [37].
Data eksperimental menunjukkan bahwa interaksi antara reseptor sel T limfosit T teraktivasi dan sel penyajian antigen serumpunnya dapat menurunkan regulasi mGluR5 dan menginduksi ekspresi mGluR1 [164]. Pada model hewan, pengikatan kelebihan glutamat ke reseptor limfositik mGluR1 meningkatkan produksi sitokin Th1, termasuk IFN-? [164].
Kami berhipotesis bahwa pada beberapa pasien MDD, sejajar dengan data eksperimental [164], pengikatan kelebihan glutamat SSP ke reseptor mGluR1 limfositik yang diinduksi dapat berkontribusi pada respon Th1 yang berlebihan, termasuk IFN-? (Gambar 2). Kami berspekulasi bahwa IFN-? dalam jumlah kecil, mirip dengan efek in vitro pada mikroglia [166], dapat menginduksi ekspresi mikroglial dari MHC-II dan EAAT2 [163,166], memungkinkan mikroglia untuk berfungsi sebagai sel penyajian antigen serumpun dan untuk menyediakan fungsi pengambilan kembali glutamat [163,164,166], sehingga mengubah mikroglia berbahaya menjadi fenotipe pelindung saraf [163,166] yang berpartisipasi dalam menghilangkan glutamat ekstraseluler berlebih [163,164,166]. Oleh karena itu, kami juga berhipotesis bahwa respon Th1 yang berlebihan pada subkelompok pasien MDD adalah pedang bermata dua, mempromosikan peradangan berbahaya dan berfungsi sebagai mekanisme kontra-regulasi yang menguntungkan yang dapat membatasi kelebihan neuroexcitotoxicity terkait glutamat (Gambar 2).
Pada skizofrenia, sementara beberapa studi sitokin perifer menunjukkan dominasi imunofenotipe/respon Th2 antiinflamasi [52], yang lain membantahnya [173,174]. Namun, kami setuju dengan penulis yang berhipotesis bahwa respon Th2 adalah fenotip dominan pada skizofrenia [52]. Peningkatan kadar KYNA otak, CSF, dan serum [21,52] menunjukkan penurunan regulasi mikro-glial IDO dan KMO, yang merupakan fungsi dari respons Th2 yang menggeser katabolisme KYN astroglial menuju sintesis KYNA (Gambar 1) [21,52]. Berkurangnya aktivitas KMO dan ekspresi mRNA KMO pada otak skizofrenia post-mortem [73] konsisten dengan respon Th2 berlebih (Gambar 1). Peningkatan prevalensi kelainan imunitas humoral yang dimediasi Th2 pada subkelompok pasien skizofrenia yang dibuktikan dengan peningkatan jumlah sel B [21,76], meningkat�produksi autoantibodi termasuk antibodi antivirus [76] dan peningkatan imunoglobulin E [52] menambahkan dukungan lebih lanjut untuk hipotesis dominasi respons Th2.
Neuroinflamasi & Disregulasi Glutamat SSP
Glutamat memediasi kognisi dan perilaku [186]. Tingkat glutamat sintetis diatur oleh EAATs glial dan neuronal tinggi yang berhubungan dengan afinitas tinggi, yaitu sistem XAG yang bertanggung jawab untuk pelepasan reuptake / aspartat glutamat [137,164] dan sistem antiporter glutamat / astrosit astrologi-natrium-independen (Xc-) bertanggung jawab untuk pelepasan glutamat / sistin reuptake [164]. Astroglial EAAT1 dan EAAT2 memberikan lebih dari 90% glutamat re-taketake [79].
Neuroinflamasi dapat mengubah metabolisme glutamat dan fungsi transporternya [15,29,187,188], menghasilkan gangguan kognitif, perilaku, dan kejiwaan [15,21,29,79,186,188,189]. Kelainan fungsi / ekspresi EAATs dan metabolisme glutamat di MDD, BPD, skizofrenia, dan OCD dirangkum dalam Tabel 2.
Di MDD, ada bukti adanya hyperglutamatergia kortikal (Tabel 2). Kadar glutamat kortikal berkorelasi positif dengan tingkat keparahan gejala depresi, dan antidepresan lima minggu menurunkan konsentrasi serum glutamat [85,86]. Dosis ketamin tunggal, antagonis NMDAR yang manjur, dapat membalikkan MDD tahan api selama seminggu [17,21,29,85]. Kelebihan kadar glutamat SSP dapat menyebabkan inflamasi yang dimediasi oleh neurotoxicity [163,164,188], termasuk respon Th1 proinflamasi (Gambar 2) [164].
Bukti in vitro yang terbatas menunjukkan bahwa sitokin inflamasi / proinflamasi dapat meningkatkan kadar glutamat SSP [188] dalam siklus umpan maju melalui beberapa mekanisme potensial: 1) sitokin proinflamasi dapat menghambat [15,17,168] dan membalikkan [45,137] glutamat yang dimediasi oleh astroglial EAAT fungsi reuptake; 2) sitokin proinflamasi dapat meningkatkan sintesis asam kuinolinat mikroglial [53], yang secara eksperimental terbukti meningkatkan pelepasan glutamat sinaptosom [15,17,29,190]; 3) meningkatkan COX-2 / PGE-2 dan TNF-? kadar dapat menyebabkan masuknya kalsium [137], yang, berdasarkan data in vitro, dapat meningkatkan glutamat astroglial dan pelepasan serin-D [191]; dan 4) mikroglia teraktivasi dapat mengekspresikan sistem antiporter Xc berlebih yang memediasi pelepasan glutamat [164,192].
Pada skizofrenia, hipoglutamatergia kortikal prefrontal [87,90,193,194] (Tabel 2) dan penurunan fungsionalitas NMDAR ditemukan [5]. Meta-analisis spektroskopi resonansi magnetik (MRS) H1 baru-baru ini (28 studi, 647 skizofrenia, 608 kontrol) mengkonfirmasi penurunan glutamat dan peningkatan kadar glutamin di korteks frontal medial [90]. Peran kontribusi inflamasi terhadap hipoglutamatergia tidak terbukti. Sintesis KYNA yang meningkat pada otak skizofrenia [21,52], biasanya merupakan fungsi respons Th2 (Gambar 1), dapat menghambat subunit NR1 dari NMDAR dan nikotinik alfa 7�acetylcholine receptor (? 7nAchR) [195], menyebabkan penurunan fungsi NMDAR dan pengurangan pelepasan glutamat yang dimediasi? 7nAchR [195].
Di BPD dan OCD, data menunjukkan adanya hiper glutamatergia korteks pada kedua kelainan (Tabel 2) [78,84,88,131]. Kontribusi peradangan (BPD dan OCD) dan autoantibodi (OCD) [7,77,84,88,130] terhadap peningkatan kadar glutamat CNS memerlukan penyelidikan lebih lanjut.
Peran S100B
S100B adalah protein pengikat kalsium 10 kDa yang diproduksi oleh astroglia, oligodendroglia, dan sel ependymal plexus koroid [196]. Ini memediasi efeknya pada neuron dan glia sekitarnya melalui reseptor untuk produk akhir glikasi lanjutan [196]. Kadar S100B ekstraseluler nanomolar memberikan efek neurotropik yang menguntungkan, membatasi cedera saraf terkait stres, menghambat TNF- mikroglial? melepaskan, dan meningkatkan pengambilan kembali glutamat astroglial [196]. Konsentrasi mikromolar S100B, terutama diproduksi oleh astroglia dan limfosit yang diaktifkan [196,197], memiliki efek berbahaya yang ditransduksi oleh reseptor untuk produk akhir glikasi lanjutan yang mencakup apoptosis neuronal, produksi COX-2 / PGE-2, IL-1? dan spesies oksida nitrat yang dapat diinduksi, dan peningkatan regulasi TNF- monositik / mikroglial? sekresi [21,196,198].
Serum dan, khususnya, CSF dan jaringan otak S100B adalah indikator aktivasi glial (didominasi astroglial) [199]. Dalam MDD dan psikosis, kadar serum S100B berkorelasi positif dengan tingkat keparahan suicidality, terlepas dari diagnosis psikiatri [200]. Analisis post-mortem S100B menunjukkan penurunan kadar korteks prefrontal dorso- lateral MDD dan BPD, dan peningkatan kadar korteks parietal BPD [196].
Meta-analisis (193 mood disorder, 132 kontrol sehat) memastikan peningkatan kadar serum dan CSF S100B dalam gangguan mood, terutama selama episode depresi akut dan mania [201].
Pada skizofrenia, tingkat otak, CSF dan serum S100B meningkat [199,202]. Meta-analisis (12 studi, 380 skizofrenia, 358 kontrol sehat) mengkonfirmasi peningkatan kadar serum S100B pada skizofrenia [203]. Pada otak post-mortem subjek skizofrenia, astroglia imunoreaktif S100B ditemukan di area yang terlibat dalam skizofrenia, termasuk korteks cingulate anterior, korteks prefrontal dorsolateral, korteks orbitofrontal, dan hippocampi [154]. Peningkatan kadar S100B berkorelasi dengan paranoid [154] dan psikosis negativistik [204], gangguan kognisi, respon terapeutik yang buruk dan durasi penyakit [202]. Polimorfisme genetik pada S100B [32] dan reseptor untuk gen produk akhir glikasi lanjut pada kohort skizofrenia (Tabel 2) [32,33,205] menyarankan kelainan ini kemungkinan primer/patogen daripada sekunder/biomarker. Memang, penurunan kadar S100B serum setelah pengobatan dengan antidepresan [201] dan antipsikotik [196] menyarankan�beberapa relevansi klinis S100B terhadap patofisiologi gangguan kejiwaan.
Neuroinflamasi & Peningkatan Stres Oksidatif
Stres oksidatif adalah suatu kondisi di mana kelebihan oksidan merusak atau memodifikasi makromolekul biologis seperti lipid, protein dan DNA [206-209]. Kelebihan ini diakibatkan oleh peningkatan produksi oksidan, penurunan oksidan, pertahanan antioksidan yang cacat, atau kombinasi keduanya [206-209]. Otak sangat rentan terhadap stres oksidatif karena: 1) peningkatan jumlah asam lemak tak jenuh ganda peroksidizabel; 2) kandungan trace mineral yang relatif tinggi yang menginduksi peroksidasi lipid dan radikal oksigen (misalnya besi, tembaga); 3) pemanfaatan oksigen tinggi; dan 3) mekanisme anti-oksidasi terbatas [206,207].
Kelebihan stres oksidatif dapat terjadi pada MDD [206], BPD [206,207], skizofrenia [207,209], dan OCD [206,208]. Penanda periferal gangguan oksidatif meliputi peningkatan produk peroksidasi lipid (misalnya malondialdehida dan 4-hydroxy-2-nonenal), peningkatan metabolit nitrat oksida (NO), penurunan antioksidan (misalnya glutathione) dan tingkat enzim antioksidan yang berubah [206,207].
Dalam MDD, peningkatan produksi anion radikal superoksida berkorelasi dengan peningkatan apoptosis neutrofil yang diinduksi oksidasi [206]. Tingkat serum enzim antioksidan (misalnya, superoksida dismutase-1) meningkat selama episode depresi akut dan menormalkan terapi selektif serotonin reuptake inhibitor (SSRI). [206]. Ini menunjukkan bahwa di MDD, tingkat enzim antioksidan serum adalah penanda keadaan, yang mungkin mencerminkan mekanisme kompensasi yang melawan peningkatan akut pada stres oksidatif. [206]. Sebaliknya, dalam skizofrenia, kadar CSF terlarut superoksida dismutase-1 secara substansial menurun pada pasien skizofrenia awitan dini dibandingkan dengan pasien skizofrenia kronik dan kontrol sehat. Hal ini menunjukkan bahwa tingkat enzim antioksidan otak yang berkurang dapat menyebabkan kerusakan oksidatif pada skizofrenia akut [210], walaupun penelitian yang lebih besar diperlukan untuk mengkonfirmasi temuan ini.
Beberapa penelitian eksperimental dan manusia tambahan meneliti secara lebih rinci mekanisme yang mendasari patofisiologi peningkatan stres oksidatif pada gangguan kejiwaan [206-262]. Pada model depresi hewan, tingkat glutathione otak berkurang sementara peroksidasi lipid dan tingkat NO meningkat [206,262].
Studi postmortem menunjukkan penurunan kadar glutathione total pada MDD, BPD [206] dan subyek skizofrenia [206,207]. Fibroblast yang dikultur dari pasien MDD menunjukkan peningkatan stres oksidatif yang terlepas dari tingkat glutathione [262], dengan alasan melawan peran utama dari deplesi glutathione sebagai mekanisme utama stres oksidatif dalam depresi.
Aktivasi mikroglial dapat meningkatkan stres oksidatif melalui produksi sitokin proinflamasi dan NO [206-209]. Sitokin proinflamasi dan kadar NO yang tinggi dapat mendorong pembentukan spesies oksigen reaktif (ROS), yang pada gilirannya mempercepat peroksidasi lipid, merusak membran fosfolipid dan reseptor neurotransmitter monoamine yang terikat membran serta mengurangi antioksidan endogen. Peningkatan produk ROS dapat meningkatkan aktivasi mikroglial dan meningkatkan produksi proinflamasi melalui stimulasi NF-? B [208], yang pada gilirannya melanggengkan cedera oksidatif [208], menciptakan potensi untuk umpan balik positif patologis pada beberapa gangguan kejiwaan [206-209]. Meskipun peradangan saraf dapat meningkatkan kadar glutamat otak [85,86], peran hiperaktif glutamatergik sebagai penyebab stres oksidatif tetap tidak berdasar [207].
Disfungsi mitokondria dapat menyebabkan peningkatan stres oksidatif pada MDD, BPD dan skizofrenia [206]. Studi postmortem pada gangguan ini mengungkapkan kelainan pada DNA mitokondria, konsisten dengan tingginya prevalensi gangguan kejiwaan pada gangguan mitokondria primer [206]. Penelitian hewan in vitro menunjukkan bahwa sitokin proinflamasi, seperti TNF- ?, dapat mengurangi kepadatan mitokondria dan merusak metabolisme oksidatif mitokondria [211,212], yang menyebabkan peningkatan produksi ROS [206,213]. Temuan eksperimental ini mungkin menyiratkan hubungan mekanis antara peradangan saraf, disfungsi mitokondria dan stres oksidatif [206,213], yang membutuhkan penyelidikan lebih lanjut dari jalur patogen yang berpotongan ini pada gangguan kejiwaan manusia.
Kerentanan jaringan saraf terhadap kerusakan oksidatif bervariasi di antara berbagai gangguan kejiwaan berdasarkan jalur neuroanatomis, neurokimia dan molekuler yang terlibat dalam gangguan spesifik [207]. Efek pengobatan juga penting, karena bukti pendahuluan menunjukkan bahwa antipsikotik, SSRI dan stabilisat mood memiliki sifat antioksidan [206,207,262]. Peran terapeutik dari antioksidan ajuvan (misalnya, vitamin C dan E) dalam gangguan kejiwaan masih harus dibuktikan dengan percobaan klinis acak bertenaga tinggi. N-acetylcysteine menunjukkan hasil yang paling menjanjikan saat ini, dengan beberapa uji coba terkontrol plasebo acak yang menunjukkan keefektifannya pada MDD, BPD dan skizofrenia [207].
Disfungsi Barrier Darah-Otak
BBB mengamankan status istimewa kekebalan otak dengan membatasi masuknya mediator inflamasi perifer, termasuk sitokin dan antibodi yang dapat mengganggu transmisi saraf [214,215]. Hipotesis kerusakan BBB dan perannya pada beberapa pasien psikiatri [60,214,216,217] konsisten dengan peningkatan prevalensi komorbiditas psikiatri pada penyakit yang terkait dengan disfungsinya, termasuk SLE [97], stroke [11],�epilepsi [218] dan ensefalitis autoimun (Tabel 1). Peningkatan "CSF: rasio albumin serum" pada pasien dengan MDD dan skizofrenia menunjukkan peningkatan permeabilitas BBB [214].
Dalam satu studi (subjek psikiatris 63, kontrol 4,100), kelainan CSF yang mengindikasikan kerusakan BBB terdeteksi pada 41% subjek psikiatri (14 MDD dan BPD, skizofrenia 14), termasuk sintesis IgG, IgM, dan / atau IgA intratekal, pleositosis CSF ringan (sel 5 ke 8 per mm3) dan kehadiran hingga empat pita oligoklonal IgG [216]. Satu studi ultrastruktural post-mortem pada skizofrenia menunjukkan kelainan ultrasruktural BBB pada korteks prefrontal dan visual, yang meliputi degenerasi vacuolar sel endotel, proses kaki-kaki astroglial, dan penebalan dan ketidakteraturan lamina basal [60]. Namun, dalam penelitian ini, penulis tidak mengomentari potensi kontribusi perubahan postmortem terhadap temuan mereka. Studi lain yang menyelidiki transkriptomik sel endotel BBB pada otak skizofrenia mengidentifikasi perbedaan yang signifikan di antara gen yang mempengaruhi fungsi imunologi, yang tidak terdeteksi pada kontrol [217].
Disfungsi endotelal yang dimediasi oksidasi dapat berkontribusi pada patofisiologi disfungsi BBB pada gangguan kejiwaan. Bukti tidak langsung dari studi klinis dan eksperimental dalam depresi [219] dan, pada tingkat yang lebih rendah, pada skizofrenia [220] menunjukkan bahwa peningkatan oksidasi dapat menyebabkan disfungsi endotel. Disfungsi endotel dapat mewakili mekanisme bersama yang memperhitungkan hubungan yang diketahui antara depresi dan penyakit kardiovaskular [219,221], yang mungkin terkait dengan penurunan kadar vasodilator NO [221-223]. Studi eksperimental menunjukkan bahwa penurunan kadar NO endotelial secara mekanis terkait dengan uncoupling dari endotel oksida oksida sintase (eNOS) dari faktor tetrahidrobiopterin co-faktor utamanya (BH4), menggeser substratnya dari L- arginine ke oksigen [224-226]. ENOS yang tidak dilapisi mempromosikan sintesis ROS (misalnya, superoksida) dan spesies nitrogen reaktif (RNS) (misalnya peroksinitrit; produk dari interaksi superoksida dengan NO) [227] daripada NO, yang menyebabkan disfungsi endotelasi yang dimediasi dengan oksidasi [ 224-226].
Data hewan menunjukkan bahwa SSRI dapat mengembalikan tingkat NO endothelial NO [219] yang menunjukkan bahwa mekanisme anti-oksidatif dapat menyebabkan efek antidepresan mereka. Pada manusia, L-methylfolate dapat mempotensiasi efek anti-depresan SSRI [228], secara serentak dengan meningkatkan kadar BH4, yang merupakan kofaktor penting untuk re-coupling-mediated anti-oxidation [229], dan juga untuk tingkat -limiting enzim monoamina (yaitu serotonin, norepinephrine, dopamine) sintesis [228].
Secara bersama-sama, kedua karya baru-baru ini menekankan peran stres oksidatif yang diinduksi eNOS dalam patogenesis penyakit vaskular [230,231] danstudi epidemiologi yang menetapkan depresi sebagai faktor risiko dependen untuk patologi vaskular, seperti stroke dan penyakit jantung [219,221], menambahkan dukungan lebih lanjut terhadap relevansi klinis kerusakan oksidatif endometrium eNOS yang tidak dilepaskan pada depresi. Meskipun terdapat banyak bukti kelainan sitokin pada penyakit kejiwaan manusia dan data eksperimen yang menunjukkan bahwa sitokin proinflamasi dapat mengurangi ekspresi eNOS [212] dan meningkatkan permeabilitas BBB [215], bukti manusia yang secara langsung menghubungkan sitokin proinflamasi berlebih terhadap disfungsi eNOS dan / atau gangguan BBB adalah kurang.
Pencitraan & Mengobati Peradangan Pada Penyakit Kejiwaan
Pencitraan Neuroinflamasi di Situ
Secara klinis, pencitraan neuroinflamasi mungkin terbukti penting untuk mengidentifikasi subkelompok pasien psikiatri dengan neuroinflamasi yang kemungkinan besar akan merespons terapi imunomodulator dengan baik. Selain itu, pencitraan semacam itu memungkinkan dokter untuk memantau aktivitas penyakit terkait neuroinflamasi dan responsnya terhadap terapi kekebalan pada pasien psikiatri. Imaging peradangan di otak manusia secara tradisional bergantung pada MRI atau visualisasi CT agen kontras intravena berlemak, yang menunjukkan kerusakan lokal BBB. MRI yang disempurnakan Gadolinium kadang-kadang menunjukkan gangguan semacam itu di daerah limbik yang terkait dengan pemrosesan emosional pada pasien dengan gangguan kejiwaan yang disebabkan oleh paraneoplastik atau ensefalitis lainnya [107,109,113]. Namun, sepengetahuan kita, peningkatan abnormal tidak pernah ditunjukkan pada gangguan kejiwaan klasik manapun [21,214,232], terlepas dari kelainan fungsional [214,216] dan ultrastructural BBB [60].
Apakah neuroinflammasi yang halus dapat divisualisasikan secara in vivo dalam gangguan kejiwaan klasik masih belum diketahui. Salah satu teknik yang menjanjikan adalah positron emission tomography (PET) dengan menggunakan radiotracers, seperti C11- PK11195, yang mengikat protein translokator, yang sebelumnya dikenal sebagai reseptor benzodiazepin perifer, yang ditunjukkan dengan mikroglia aktif [233,234].
Dengan menggunakan metode ini, pasien dengan skizofrenia ditunjukkan memiliki aktivasi mikroglial yang lebih besar di seluruh korteks [235] dan di hippocampus selama psikosis akut [236]. Satu studi (14 skizofrenia, kontrol 14) tidak menemukan perbedaan yang signifikan antara [11C] DAA1106 yang mengikat skizofrenia versus kontrol, namun korelasi langsung antara [11C] DAA1106 mengikat dan tingkat keparahan gejala positif dan durasi penyakit pada skizofrenia [236].
Penyidik dari institusi kami menggunakan PET C11-PK11195 untuk menunjukkan peradangan bi-hippocampal pada pasien dengan disfungsi neuropsikiatri, termasuk MDD psikotik, epilepsi, dan amnesia anterograde, terkait dengan antibodi anti-GAD [237]. Namun, PET PK11195 memiliki�sifat signal-to-noise yang rendah dan memerlukan siklotron di tempat.
Oleh karena itu, penelitian ditujukan untuk mengembangkan ligan protein translokator yang ditingkatkan untuk PET dan SPECT. Jaringan otak post-mortem bertenaga tinggi yang menggunakan data kuantifikasi bertujuan untuk menjelaskan jalur metabolisme dan inflamasi, sitokin SSP dan reseptor pengikatnya, dalam gangguan kejiwaan diperlukan untuk memajukan pemahaman kita tentang patofisiologi autoimun.
Peran Obat Antiinflamasi Pada Gangguan Psikiatri
Beberapa penelitian manusia dan hewan menunjukkan bahwa obat antiinflamasi tertentu dapat memainkan peran tambahan yang penting dalam pengobatan gangguan kejiwaan (Tabel 3). Obat umum adalah penghambat siklooksigenase (Tabel 3) [238-245], minocycline (Tabel 3) [240-245], asam lemak omega-3 [246,247], dan neurosteroid [248].
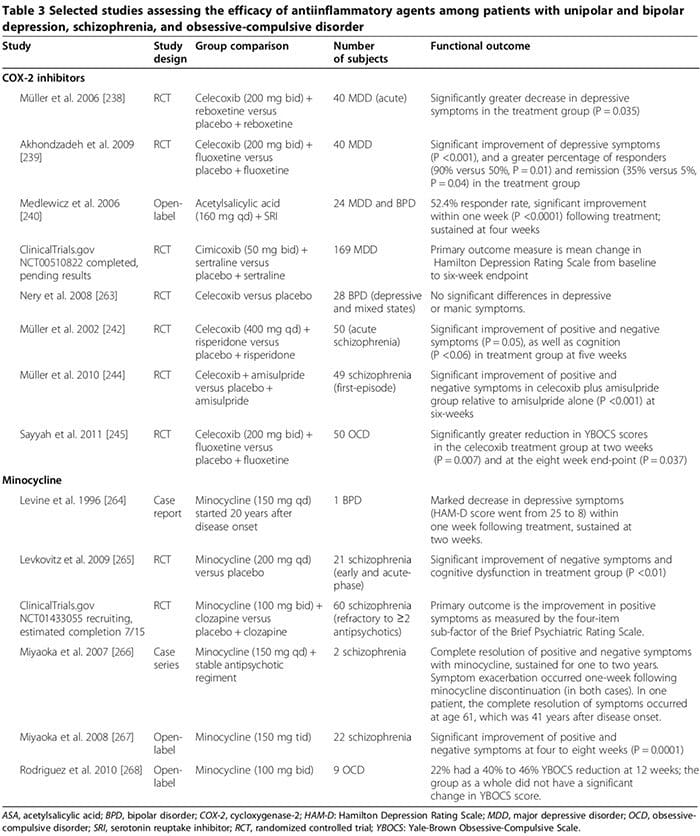 Beberapa penelitian manusia menunjukkan bahwa inhibitor COX-2 dapat memperbaiki gejala psikiatri MDD, BPD, skizofrenia dan OCD (Tabel 3) [248]. Sebaliknya, pengobatan tambahan dengan penghambat COX non-selektif (yaitu, obat antiinflamasi non steroid (NSAID)) dapat mengurangi keefektifan SSRI [249,250]; dua percobaan besar melaporkan bahwa paparan NSAID (tapi tidak untuk inhibitor COX-2 selektif atau salisilat) dikaitkan dengan penurunan depresi yang signifikan di antara sub-kelompok peserta studi [249,250].
Beberapa penelitian manusia menunjukkan bahwa inhibitor COX-2 dapat memperbaiki gejala psikiatri MDD, BPD, skizofrenia dan OCD (Tabel 3) [248]. Sebaliknya, pengobatan tambahan dengan penghambat COX non-selektif (yaitu, obat antiinflamasi non steroid (NSAID)) dapat mengurangi keefektifan SSRI [249,250]; dua percobaan besar melaporkan bahwa paparan NSAID (tapi tidak untuk inhibitor COX-2 selektif atau salisilat) dikaitkan dengan penurunan depresi yang signifikan di antara sub-kelompok peserta studi [249,250].
Pada percobaan pertama, melibatkan pasien depresi 1,258 yang diobati dengan citalopram untuk 12 minggu, tingkat remisi secara signifikan lebih rendah di antara mereka yang telah menggunakan NSAID setidaknya sekali dibandingkan mereka yang tidak memiliki 45% versus 55%, OR 0.64, P = 0.0002) [249]. Uji coba lainnya, yang melibatkan subyek 1,545 MDD, menunjukkan tingkat depresi yang tahan terhadap pengobatan secara signifikan lebih tinggi di antara mereka yang menggunakan NSAID (OR 1.55, 95% CI 1.21 to 2.00) [231]. Memburuknya depresi pada kelompok NSAID mungkin tidak terkait secara mekanis dengan terapi NSAID namun dikaitkan dengan kondisi medis kronis yang ada bersamaan [10,12-18] yang memerlukan NSAID jangka panjang dan yang diketahui terkait secara independen dengan peningkatan risiko depresi tahan pengobatan [249,251]. Studi masa depan yang menyelidiki dampak NSAID pada depresi dan respons terhadap antidepresan pada manusia diperlukan.
Dalam studi eksperimental lain yang menggunakan paradigma stres akut untuk menginduksi keadaan seperti depresi pada tikus, citalopram meningkatkan TNF-?, IFN-?, dan p11 (faktor molekuler terkait dengan perilaku depresi pada hewan) di korteks frontal, sedangkan ibuprofen NSAID penurunan molekul ini; NSAID juga melemahkan efek antidepresan SSRI tetapi bukan antidepresan lain [249]. Temuan ini menunjukkan bahwa sitokin proinflamasi mungkin secara paradoks mengerahkan efek antidepresan meskipun banyak bukti dari�studi manusia sebaliknya (seperti yang diulas di atas), yang dapat dilemahkan oleh NSAID [249]. Setidaknya dua pertimbangan dapat menjelaskan paradoks yang tampak ini: 1) di bawah beberapa kondisi eksperimental, sitokin proinflamasi telah dikaitkan dengan peran pelindung saraf, [251; (untuk�Misalnya, IFN-? dalam tingkat rendah dapat menyebabkan mikroglia pelindung saraf (Gambar 2) [163,166,251]); dan 2) apakah tanggapan ini diamati dalam konteks paradigma stres akut pada model hewan yang dapat diterapkan untuk MDD endogen pada manusia masih belum jelas [251].
Efek terapeutik inhibitor COX-2 pada gangguan kejiwaan mungkin melibatkan modulasi biosintesis prostaglandin turunan COX-2, termasuk PGE2 proinflamasi dan antiinflamasi 15-deoksi-? 12,14-PGJ2 (15d- PGJ2) [252,253]. Inhibitor COX-2 dapat mengurangi inflamasi yang dimediasi oleh PGE2, yang dapat berkontribusi pada patofisiologi gangguan kejiwaan [252,253]. Mereka juga dapat mengubah level 15d-PGJ2, dan aktivitas reseptor nuklir peroksisom proliferator-diaktifkan reseptor nuklir gamma (PPAR-?) [252,253].
Beberapa penelitian menunjukkan bahwa 15d-PGJ2 dan reseptor nuklirnya PPAR-? dapat berfungsi sebagai penanda biologis untuk skizofrenia [253]. Pada pasien skizofrenia, kadar serum PGE2 meningkat, sedangkan kadar serum 15d-PGJ2 menurun, demikian pula ekspresi reseptor nuklirnya PPAR-? dalam PBMC [252]. Sementara inhibitor COX-2 dapat membatasi potensi efek antiinflamasi yang bermanfaat dari �2d-PGJ15/PPAR-? jalur�, mereka dapat secara menguntungkan mengurangi efek berbahayanya, termasuk 2) peningkatan risiko infark miokard dan infeksi tertentu (misalnya, cytomegalovirus dan Toxoplasma gondii) pada pasien skizofrenia [1] dan 254) efek pro-apoptosisnya diamati pada jaringan kanker manusia dan hewan [2]. Mekanisme potensial lain dari efek terapeutik penghambat COX-255 mungkin melibatkan kemampuannya untuk mengurangi kadar sitokin proinflamasi [2], membatasi eksitotoksisitas asam quinolinic (seperti pada MDD) dan menurunkan kadar KYNA (seperti pada skizofrenia) [163].
Minosiklin bisa efektif dalam gangguan kejiwaan (Tabel 3) [248]. Data in vitro menunjukkan bahwa minosiklin menghambat MAP, sekresi sitokin, ekspresi COX-2/PGE-2, dan sintase nitrat oksida yang dapat diinduksi [256]. Minosiklin juga dapat menangkal neurotransmisi glutamatergik dan dopaminergik yang tidak teratur [256].
Efektivitas asam lemak omega-3 pada gangguan kejiwaan tidak jelas [248]. Dalam meta-analisis 2011 dari 15 uji coba terkontrol secara acak (916 MDD), suplemen omega-3 yang mengandung asam eicosapentaenoic ?60% (rentang dosis 200 hingga 2,200 mg/hari melebihi dosis asam docosahexaenoic) secara signifikan menurunkan gejala depresi sebagai terapi tambahan untuk SRI (P <0.001) [246]. Sebuah meta-analisis selanjutnya, bagaimanapun, menyimpulkan bahwa tidak ada manfaat yang signifikan dari asam lemak omega-3 dalam depresi dan bahwa kemanjuran yang diklaim hanyalah hasil dari bias publikasi [247]. Sebuah meta-analisis 2012 dari 5 uji coba terkontrol secara acak termasuk 291 peserta BPD menemukan bahwa gejala depresi, tetapi tidak manik, meningkat secara signifikan di antara mereka yang diacak menjadi asam lemak omega-3 relatif terhadap mereka yang menggunakan plasebo (Hedges g 0.34, P = 0.025) [257]. Dalam uji coba terkontrol secara acak dari subjek skizofrenia yang diikuti hingga 12 bulan, skor gejala positif dan negatif secara signifikan menurun di antara 66 peserta yang diacak untuk omega-3 rantai panjang (1.2 g/hari selama 12 minggu; P = 0.02 dan 0.01, masing-masing) [258]; itu�Penulis menyimpulkan bahwa pembesaran omega-3 selama awal skizofrenia juga dapat mencegah kambuh dan perkembangan penyakit [258].
Analisis meta-2012 terhadap tujuh uji coba terkontrol secara acak yang menilai pembesaran omega-3 pada pasien schizophrenia 168 tidak menemukan manfaat pengobatan [259]. Penulis meta-analisis ini secara khusus menyatakan bahwa tidak ada kesimpulan yang dapat ditarik mengenai titik akhir pencegahan penyakit kambuh atau penyakit [259]. Data eksperimental menunjukkan bahwa asam eicosapentaenoic dan asam docosahexaenoic memediasi efek antiinflamasi mereka dengan mempromosikan sintesis resolvin dan protin, yang dapat menghambat infiltrasi leukosit dan mengurangi produksi sitokin [248].
Neurosteroid, termasuk pregnenolone dan allopregnanolon metabolit hilirnya, mungkin memiliki peran menguntungkan pada beberapa gangguan kejiwaan [248,260]. Dalam MDD, beberapa penelitian menemukan penurunan kadar allopregnanolone plasma / CSF yang berkorelasi dengan tingkat keparahan gejala, yang dinormalisasi setelah pengobatan yang berhasil dengan antidepresan tertentu (misalnya SSRI), dan terapi electroconvulsive [261]. Pada skizofrenia, kadar hormon kehamilan dapat diubah [248] dan kadar allopregnanolon serum dapat meningkat setelah beberapa obat antipsikotik (misalnya, clozapine dan olanzapine) [260]. Dalam tiga percobaan acak terkontrol (100 skizofrenia (gabungan), durasi pengobatan, sekitar sembilan minggu) gejala positif, negatif, dan kognitif, serta efek samping ekstrapiramidal antipsikotik meningkat secara signifikan dalam satu atau lebih percobaan di antara mereka yang diacak menjadi pregnancyenolone relatif terhadap mereka yang menerima plasebo [248]. Dalam satu percobaan, perbaikan dilanjutkan dengan terapi hormonin jangka panjang [248]. Pregnenolone dapat mengatur kognisi dan perilaku dengan mempotensiasi fungsi reseptor NMDA dan GABAA [248]. Selanjutnya, allopregnanolone dapat memberikan efek neuroprotective dan antiinflamasi [248]. Diperlukan penelitian RCT untuk mengkonfirmasi peran steroid neuroaktif yang menguntungkan pada gangguan psikiatris dini pada manusia.
Kami sedang menunggu hasil dari beberapa uji klinis yang sedang berlangsung yang menyelidiki efek terapeutik dari agen anti-inflamasi lainnya, termasuk salisilat, penghambat NF-? B (NCT01182727); asam asetilsalisilat (NCT01320982); pravastatin (NCT1082588); dan dekstrometorfan, antagonis NMDAR non-kompetitif yang dapat membatasi cedera saraf dopaminergik akibat inflamasi (NCT01189006).
Strategi Pengobatan Masa Depan
Meskipun terapi imun saat ini (misalnya, IVIG, plasmaferesis, kortikosteroid dan agen imunosupresif) seringkali efektif untuk mengobati ensefalitis autoimun dimana peradangan bersifat akut, intens dan sebagian besar berasal dari adaptif, kemanjurannya pada gangguan kejiwaan klasik dimana peradangan bersifat kronis,�jauh lebih ringan, dan didominasi asal lahir, terbatas [2]. Pengembangan terapi baru harus bertujuan untuk membalikkan hilangnya glial [46,138], menurunkan regulasi MAP berbahaya, sekaligus mengoptimalkan titer neuroprotektif endogen dan MAP yang bermanfaat, dan bukan peradangan supertif seperti pada agen imunosupresif saat ini. Selain itu, pengembangan antioksidan ajuvan yang kuat yang bisa membalikkan cedera oksidatif pada gangguan kejiwaan sangat dibutuhkan.
Kesimpulan
Autoimunitas dapat menyebabkan sejumlah gangguan neuropsikiatri yang pada awalnya dapat hadir dengan gejala psikiatri yang terisolasi. Peradangan / autoimunitas bawaan mungkin relevan dengan patogenesis gejala psikiatri pada subset pasien dengan gangguan kejiwaan klasik. Peradangan bawaan mungkin terkait secara mekanis dengan kelainan monoaminergik dan glutamatergik tradisional dan peningkatan cedera oksidatif yang dilaporkan terjadi pada penyakit kejiwaan.
Souhel Najjar1,5 *, Daniel M Pearlman2,5, Kenneth Alper4, Amanda Najjar3 dan Orrin Devinsky1,4,5
Singkatan
3-OH-KYN: 3-hidroksi-kinurenin; ?7nAchR: Reseptor asetilkolin nikotinat alfa 7; AMPAR: Reseptor asam amino-3-hidroksi-5-metil-l-4-isoksazolpropionat; APC: Sel penyaji antigen; BBB: Penghalang darah-otak;
BH4: Tetrahydrobiopterin; BPD: gangguan bipolar; CI: Interval kepercayaan;
SSP: Sistem saraf pusat; COX-2: Cyclooxegenase-2; CSF: cairan serebrospinal; DSM-IV: Manual Diagnostik dan Statistik Gangguan Mental 4th Edition; EAAT: transporter asam amino rangsang; eNOS: Sintesis nitrat oksida endothelial; GABAB: Gamma aminobutyric acid-beta; GAD: asam glutamat dekarboksilase; GFAP: Protein asam fibriler glial; GLX: 1H MRS glutamat terdeteksi, glutamin, kompartemen asam aminobutyrik gamma;
IDO: Indoleamine 2,3-dioxygenase; Ig: Imunoglobulin; IL: Interleukin; IL-1RA: Antagonis reseptor interleukin 1; IFN- ?: Gamma interferon;
KAT: Kynurenine aminotransferase; KMO: Kynurenine 3-monooxygenase; KYN: Kynurenine; KYNA: asam kynurenic; LE: ensefalitis Limbic;
LPS: lipopolisakarida; PETA: Aktivasi dan proliferasi mikroglial;
MDD: Gangguan depresi mayor; mGluR: Reseptor glutamat metabotropik; MHC: II Kelas dua kompleks histokompatibilitas utama; MRI: Pencitraan resonansi magnetik; MRS: Spektroskopi resonansi magnetik; NF-? B: Faktor nuklir kappa B; NMDAR: reseptor N-metil-D-aspartat; NR1: Situs glisin;
OCD: Obsesif-kompulsif; ATAU: Odds ratio; PANDAS: Gangguan autoimun neuropsikiatri pediatrik yang terkait dengan infeksi streptokokus; PBMC: sel mononuklear darah perifer; PET: Positron emission tomography; PFC: korteks prefrontal; PGE-2: Prostaglandin E2; PPAR-
?: Gamma reseptor nuklir aktif proliferator peroksisom; QA: Asam kuinolinat; RNS: Spesies nitrogen reaktif; ROS: Spesies oksigen reaktif;
sIL: Interleukin larut; SLE: lupus eritematosus sistemik; SRI: Penghambat reuptake serotonin; TNF- ?: Faktor nekrosis tumor alfa; T-regs: sel pengatur CD4 + CD25 + FOXP3 + T; TDO: Triptofan-2,3-dioksigenase; Th: Pembantu-T; VGKC: Saluran kalium dengan gerbang tegangan; XAG-: Glutamat aspartate transporter; Xc-: Sodium-independent astroglial glutamate / cystine
sistem antiporter
Bersaing Minat
Penulis menyatakan bahwa mereka tidak memiliki kepentingan bersaing.
Penulis��Kontribusi
SN dan DMP melakukan tinjauan literatur yang ekstensif, data yang diinterpretasikan, menyiapkan manuskrip, gambar, dan tabel. KA menyiapkan bagian yang berkaitan dengan mekanisme oksidatif dan berkontribusi pada revisi naskah. AN dan OD secara kritis merevisi dan memperbaiki desain dan kualitas manuskrip tersebut. Semua penulis membaca dan menyetujui manuskrip terakhir.
Ucapan Terima Kasih
Kami mengucapkan terima kasih Drs. Josep Dalmau, MD, PhD, Tracy Butler, MD, dan David Zazag, MD, PhD, untuk memberikan keahlian mereka dalam ensefalitides autoimun, pencitraan neuroinflamasi, dan neuropatologi.
Penulis�Detail
1Departemen Neurologi, Sekolah Kedokteran Universitas New York, 550 First Avenue, New York, NY 10016, AS. 2Geisel School of Medicine di Dartmouth, Institut Dartmouth untuk Kebijakan Kesehatan dan Praktik Klinik, 30 Lafayette Street, HB 7252, Lebanon, NH 03766, AS. 3Departemen Patologi, Divisi Neuropatologi, Sekolah Kedokteran Universitas New York, 550 First Avenue, New York, NY 10016, AS. 4Departemen Psikiatri, New York University School of Medicine, New York, NY, AS. 5New York University Comprehensive Epilepsy Center, 550 First Avenue, New York, NY 10016, Amerika Serikat.
Kosong
Referensi:
1. Kayser MS, Dalmau J: Hubungan yang muncul antara kelainan autoimun
dan penyakit neuropsikiatri. J Neuropsikiatri Klinik Neurosci 2011, 23:90�97.
2. Najjar S, Pearlman D, Zagzag D, Golfinos J, Devinsky O: Asam glutamat
sindrom autoantibodi dekarboksilase yang hadir sebagai skizofrenia.
Neurolog 2012, 18:88�91.
3. Graus F, Saiz A, Dalmau J: Antibodi dan autoimun neuron
gangguan pada SSP. J Neurol 2010, 257:509�517.
4. Lennox BR, Coles AJ, Vincent A: Ensefalitis yang dimediasi antibodi: a
penyebab skizofrenia yang dapat diobati. Br J Psikiatri 2012, 200:92�94.
5. Zandi MS, SR Irani, Lang B, P Waters, Jones PB, McKenna P, Coles AJ, Vincent
A, Lennox BR: Autoantibodi yang terkait dengan penyakit di episode pertama
skizofrenia. J Neurol 2011, 258:686�688.
6. Bataller L, Kleopa KA, Wu GF, Rossi JE, Rosenfeld MR, Dalmau J:
Ensefalitis limbik autoimun pada pasien 39: imunofenotip dan
hasil. J Neurol Neurosurg Psikiatri 2007, 78:381�385.
7. Dale RC, Heyman I, Giovannoni G, Gereja AW: Kejadian anti-otak
antibodi pada anak-anak dengan gangguan obsesif-kompulsif. Br J Psychiatry
2005, 187:314-319.
8. Kendler KS: Sifat alami penyebab penyakit psikiatris: berganti
dikotomi organik-fungsional / hardware-software dengan empiris
berbasis pluralisme. Psikiatri Mol 2012, 17:377�388.
9. Keskin G, Sunter G, Midi I, Tuncer N: Neurosifilis sebagai penyebab kognitif
penurunan dan gejala kejiwaan pada usia muda. J Neuropsychiatry Clin
Ilmu Saraf 2011, 23:E41�E42.
10. Leboyer M, Soreca I, Scott J, Frye M, Henry C, Tamouza R, Kupfer DJ: Bisa
Gangguan bipolar dipandang sebagai penyakit peradangan multi sistem.
J Mempengaruhi Gangguan 2012, 141:1�10.
11. Hackett ML, Yapa C, Parag V, Anderson CS: Frekuensi depresi sesudahnya
stroke: tinjauan sistematis studi observasional. Pukulan 2005, 36:1330�1340.
12. Dantzer R, O'Connor JC, Freund GG, Johnson RW, Kelley KW: Dari
Peradangan terhadap penyakit dan depresi: saat sistem kekebalan tubuh
menundukkan otak. Nat Rev Neurosci 2008, 9:46�56.
13. Laske C, Zank M, Klein R, Stransky E, Batra A, Buchkremer G, Schott K:
Autoantibody reaktivitas pada serum pasien dengan depresi berat,
skizofrenia dan kontrol yang sehat. Psikiatri Res 2008, 158:83�86.
14. Eisenberger NI, Berkman ET, Inagaki TK, Rameson LT, Mashal NM, Irwin MR:
Peradangan yang diinduksi anhedonia: endotoksin mengurangi striatum ventral
tanggapan terhadap penghargaan. Biol Psikiatri 2010, 68:748�754.
15. Haroon E, Raison CL, Miller AH: Psikoneuroimunologi bertemu
neuropsychopharmacology: implikasi translasi dari dampak
peradangan pada perilaku. Neuropsikofarmakologi 2012, 37:137�162.
16. Benros ME, Nielsen PR, Nordentoft M, Eaton WW, Dalton SO, Mortensen PB:
Penyakit autoimun dan infeksi parah sebagai faktor risiko
skizofrenia: studi register berbasis populasi 30 tahun. Am J Psychiatry
2011, 168:1303-1310.
17. McNally L, Bhagwagar Z, Hannestad J: Peradangan, glutamat, dan glia
dalam depresi: tinjauan literatur. CNS Spectr 2008, 13:501�510.
18. Harrison NA, Brydon L, Walker C, Grey MA, Steptoe A, Critchley HD:
Peradangan menyebabkan perubahan mood melalui perubahan subgenual
aktivitas cingulate dan konektivitas mesolimbik. Biol Psychiatry 2009,
66:407�414.19. Raison CL, Miller AH: Apakah depresi merupakan gangguan peradangan?
Perwakilan Psikiatri Curr 2011, 13:467�475.
20. Raison CL, Miller AH: Pentingnya evolusi depresi di Indonesia
Pertahanan Inang Patogen (PATHOS-D). Psikiatri Mol 2013, 18:15�37.
21. Steiner J, Bogerts B, Sarnyai Z, Walter M, Gos T, Bernstein HG, Myint AM:
Menjembatani kesenjangan antara hipotesis kekebalan dan glutamat
skizofrenia dan depresi berat: Peran potensial NMOS glial
modulator reseptor dan gangguan integritas sawar darah-otak. Dunia J
Biol Psikiatri 2012, 13:482�492.
22. Steiner J, Mawrin C, Ziegeler A, Bielau H, Ullrich O, Bernstein HG, Bogerts B:
Distribusi mikroglia HLA-DR-positif pada skizofrenia mencerminkan
gangguan lateralisasi serebral. Acta Neuropathol 2006, 112:305�316.
23. Papakostas GI, Shelton RC, Kinrys G, Henry ME, Bakow BR, Lipkin SH, Pi B,
Thurmond L, Bilello JA: Penilaian multi-assay, serum berbasis
uji diagnostik biologis untuk gangguan depresi mayor: pilot dan
studi replikasi. Psikiatri Mol 2013, 18:332�339.
24. Krishnan R: Depresi unipolar pada orang dewasa: epidemiologi, patogenesis, dan
neurobiologi. Di UpToDate. Diedit oleh Basow DS. Waltham, MA: UpToDate; 2013.
25. Stovall J: Gangguan bipolar pada orang dewasa: epidemiologi dan diagnosis. Di
UpToDate. Diedit oleh Basow DS. UpToDate: Waltham; 2013.
26. Fischer BA, Buchanan RW: Skizofrenia: epidemiologi dan patogenesis.
Di UpToDate. Diedit oleh Basow DS. Waltham, MA: UpToDate; 2013.
27. Nestadt G, Samuels J, Riddle M, Bienvenu OJ 3rd, Liang KY, LaBuda M,
Walkup J, Grados M, Hoehn-Saric R: Sebuah studi keluarga tentang obsessivecompulsive
kekacauan. Arch Gen Psychiatry 2000, 57:358�363.
28. Stefansson H, Ophoff RA, Steinberg S, Andreassen OA, Cichon S, Rujescu D,
Werge T, Pietilainen OP, Mors O, Mortensen PB, Sigurdsson E, Gustafsson O,
Nyegaard M, Tuulio-Henriksson A, Ingason A, Hansen T, Suvisaari J,
Lonnqvist J, Paunio T, B�rglum AD, Hartmann A, Fink-Jensen A, Nordentoft
M, Hougaard D, Norgaard-Pedersen B, Buttcher Y, Olesen J, Breuer R, Müller
HJ, Giegling I, dkk: varian umum yang memberikan risiko skizofrenia.
Alam 2009, 460:744�747.
29. M�ller N, Schwarz MJ. Perubahan serotonin dan
glutamat: menuju pandangan depresi yang terintegrasi. Mol Psychiatry
2007, 12:988-1000.
30. Galecki P, Florkowski A, Bienkiewics M, Szemraj J: Polimorfisme Fungsional
gen cyclooxygenase-2 (G-765C) pada pasien depresi.
Neuropsikobiologi 2010, 62:116�120.
31. Levinson DF: Genetika depresi: sebuah tinjauan. Biol Psychiatry 2006,
60: 84 92.
32. Zhai J, Cheng L, Dong J, Shen Q, Zhang Q, Chen M, Gao L, Chen X, Wang K,
Gen Deng X, Xu Z, Ji F, Liu C, Li J, Dong Q, Chen C: S100B
Polimorfisme memprediksi fungsi spasial prefrontal pada kedua skizofrenia
pasien dan individu sehat. Schizophr Res 2012, 134:89�94.
33. Zhai J, Zhang Q, Cheng L, Chen M, Wang K, Liu Y, Deng X, Chen X, Shen Q,
Xu Z, Ji F, Liu C, Dong Q, Chen C, Li J: varian risiko pada gen S100B,
terkait dengan peningkatan kadar S100B, juga terkait dengan
kecacatan visuospasial skizofrenia. Behav Brain Res 2011, 217:363�368.
34. Cappi C, Muniz RK, Sampaio AS, Cordeiro Q, Brentani H, Palacios SA,
Marques AH, Vallada H, Miguel EC, Guilherme L, Hounie AG: Asosiasi
studi antara polimorfisme fungsional pada gen TNF-alpha dan
gangguan obsesif kompulsif. Arq Neuropsiquiatr 2012, 70:87�90.
35. Miguel-Hidalgo JJ, Baucom C, Dilley G, Overholser JC, Meltzer HY,
Stockmeier CA, Rajkowska G: Protein asam fibrilasi glial
imunoreaktivitas di korteks prefrontal membedakan yang lebih muda dari
orang dewasa yang lebih tua dalam gangguan depresi mayor. Biol Psikiatri 2000, 48:861�873.
36. Altshuler LL, Abulseoud OA, Foland Ross L, Bartzokis G, Chang S, Mintz J,
Hellemann G, Vinters HV: Amygdala pengurangan astrosit pada subjek dengan
gangguan depresi mayor tapi bukan gangguan bipolar. Bipolar Disord 2010,
12: 541 549.
37. Webster MJ, Knable MB, Johnston-Wilson N, Nagata K, Inagaki M, Yolken RH:
Lokalisasi imunohistokimia asam fibrilasi glial terfosforilasi
protein di korteks prefrontal dan hippocampus dari pasien dengan
skizofrenia, gangguan bipolar, dan depresi. Brain Behav Immun 2001,
15: 388 400.
38. Doyle C, Deakin JFW: Lebih sedikit astrosit di korteks frontal pada skizofrenia,
depresi dan gangguan bipolar. Skizofrenia Res 2002, 53: 106.
39. Johnston-Wilson NL, Sims CD, Hofmann JP, Anderson L, AD Shore, Torrey
EF, Yolken RH: Perubahan spesifik penyakit pada protein otak korteks frontal
pada skizofrenia, gangguan bipolar, dan gangguan depresi mayor, The
Konsorsium Neuropatologi Stanley. Psikiatri Mol 2000, 5:142�149.
40. Gosselin RD, Gibney S, O'Malley D, Dinan TG, Cryan JF: Wilayah yang spesifik
penurunan imunoreaktivitas protein asam glial fibrillary di otak
model tikus depresi. Neuroscience 2009, 159:915�925.
41. Banasr M, Duman RS: Glial loss pada prefrontal cortex sudah cukup
menginduksi perilaku seperti depresi. Biol Psikiatri 2008, 64:863�870.
42. Cotter D, Hudson L, Landau S: Bukti untuk patologi orbitofrontal di Indonesia
gangguan bipolar dan depresi berat, tapi tidak pada skizofrenia.
Gangguan Bipolar 2005, 7:358�369.
43. Brauch RA, Adnan El-Masri M, Parker J Jr, El-Mallakh RS: nomor sel Glial
dan rasio sel neuron / glial pada otak postmortem individu bipolar.
J Mempengaruhi Gangguan 2006, 91:87�90.
44. Cotter DR, Pariante CM, Everall IP: Kelainan sel glial mayor
gangguan kejiwaan: bukti dan implikasinya. Brain Res Bull 2001,
55: 585 595.
45. Cotter D, Mackay D, Landau S, Kerwin R, Everall I: Mengurangi kerapatan sel glial
dan ukuran neuronal di korteks cingulate anterior pada depresi mayor
kekacauan. Arch Gen Psychiatry 2001, 58:545�553.
46. Bowley MP, Drevets WC, Ong�r D, Price JL: Angka glial rendah di
amigdala pada gangguan depresi mayor. Biol Psikiatri 2002, 52:404�412.
47. Toro CT, JE Hallak, Dunham JS, Deakin JF: Protein asam fibrilasi glial dan
glutamin sintetase di subregional korteks prefrontal pada skizofrenia
dan gangguan suasana hati. Neurosci Lett 2006, 404:276�281.
48. Rajkowska G, Miguel-Hidalgo JJ, Makkos Z, Meltzer H, Overholser J,
Stockmeier C: Pengurangan spesifik lapisan pada astroglia GFAP-reaktif di
korteks prefrontal dorsolateral pada skizofrenia. Schizophr Res 2002, 57:127�138.
49. Steffek AE, McCullumsmith RE, Haroutunian V, Meador-Woodruff JH: Kortikal
Ekspresi protein asam fibriler glial dan glutamin sintetase ini
menurun pada skizofrenia. Schizophr Res 2008, 103:71�82.
50. Damadzic R, Bigelow LB, Krimer LS, Goldenson DA, Saunders RC, Kleinman
JE, Herman MM: Studi imunohistokimia kuantitatif astrosit di Indonesia
korteks entorhinal pada skizofrenia, gangguan bipolar dan mayor
depresi: tidak adanya astrocytosis yang signifikan. Brain Res Bull 2001, 55:611�618.
51. Benes FM, McSparren J, Burung ED, SanGiovanni JP, Vincent SL: Defisit di
interneuron kecil di korteks prefrontal dan cingulate penderita skizofrenia
dan pasien skizoafektif. Arch Gen Psychiatry 1991, 48:996�1001.
52. Müller N, Schwarz MJ. Sistem kekebalan dan skizofrenia. Curr Imunol
Wahyu 2010, 6:213�220.
53. Steiner J, Walter M, Gos T, Guillemin GJ, Bernstein HG, Sarnyai Z, Mawrin C,
Brisch R, Bielau H, Meyer Zu Schwabedissen L, Bogerts B, Myint AM: Parah
depresi dikaitkan dengan peningkatan asam kuinolinat mikroglial di Indonesia
subregional dari gyrus cingulate anterior: bukti imunemodulasi
neurotransmisi glutamatergic? J Neuroinflamasi 2011, 8: 94.
54. Vostrikov VM, Uranova NA, Orlovskaya DD: Defisit perineuronal
oligodendrosit di korteks prefrontal pada skizofrenia dan mood
gangguan. Schizophr Res 2007, 94:273�280.
55. Rajkowska G, Miguel-Hidalgo JJ: Gliogenesis dan patologi glial di Indonesia
depresi. Target Obat CNS Neurol Disord 2007, 6:219�233.
56. Uranova NA, Vostrikov VM, Orlovskaya DD, Rachmanova VI:
Kepadatan Oligodendrogli di korteks prefrontal pada skizofrenia dan
Gangguan mood: sebuah studi dari Stanley Neuropathology Consortium.
Skizofr Res 2004, 67:269�275.
57. Uranova N: Kerusakan dan hilangnya oligodendrosit sangat penting dalam
patogenesis skizofrenia dan gangguan mood (bentuk temuan
studi postmortem). Neuropsychopharmacology 2004, 29: S33.
58. Uranova NA, Orlovskaya DD, Vostrikov VM, Rachmanova VI: Turun
kepadatan satelit oligodendrogli dari neuron piramid pada lapisan III di
korteks prefrontal pada skizofrenia dan gangguan mood. Restor Schizophr
2002, 53: 107.
59. Vostrikov VM, Uranova NA, Rakhmanova VI, Orlovskaia DD: Turunkan
Kepadatan sel oligodendrogli di korteks prefrontal pada skizofrenia.
Zh Nevrol Psikhiatr Im SS Korsakova 2004, 104:47�51.
60. Uranova NA, Zimina IS, Vikhreva OV, Krukov NO, Rachmanova VI, Orlovskaya
DD: Kerusakan ultrastruktural kapiler di neokorteks di Indonesia
skizofrenia. Dunia J Biol Psikiatri 2010, 11:567�578.
61. Hof PR, Haroutunian V, Friedrich VL Jr, Byne W, Buitron C, Perl DP, Davis KL:
Hilangnya dan mengubah distribusi spasial oligodendrosit di atasan
girus frontal pada skizofrenia. Biol Psikiatri 2003, 53:1075�1085.
62. Davis KL, Stewart DG, Friedman JI, Buchsbaum M, Harvey PD, Hof PR,
Buxbaum J, Haroutunian V: Perubahan materi putih pada skizofrenia:
bukti disfungsi terkait myelin. Arch Gen Psychiatry 2003,
60:443�456.63. Flynn SW, Lang DJ, Mackay AL, Goghari V, Vavasour IM, Whittall KP, Smith
GN, Arango V, Mann JJ, Dwork AJ, Falkai P, Honer WG: Kelainan pada
myelination pada skizofrenia terdeteksi in vivo dengan MRI, dan postmortem
dengan analisis protein oligodendrocyte. Mol Psikiatri 2003,
8: 811 820.
64. Uranova NA, Vostrikov VM, Vikhreva OV, Zimina IS, Kolomeets NS, Orlovskaya
DD: Peran patologi oligodendrosit pada skizofrenia. Int J
Neuropsikofarmakol 2007, 10:537�545.
65. Byne W, Kidkardnee S, Tatusov A, Yiannoulos G, Buchsbaum MS,
Haroutunian V: pengurangan neuronal terkait skizofrenia dan
bilangan oligodendrocyte di inti thalamic anterior utama.
Skizofr Res 2006, 85:245�253.
66. Hamidi M, Drevets WC, Price JL: Glial reduksi amigdala di mayor
Gangguan depresif disebabkan oligodendrosit. Biol Psychiatry 2004,
55: 563 569.
67. Bayer TA, Buslei R, Havas L, Falkai P: Bukti aktivasi mikroglia di Indonesia
pasien dengan penyakit kejiwaan. Neurosci Lett 1999, 271:126�128.
68. Steiner J, Bielau H, Brisch R, Danos P, Ullrich O, Mawrin C, Bernstein HG,
Bogerts B: Aspek imunologi dalam neurobiologi bunuh diri:
kepadatan mikroglial yang meningkat pada skizofrenia dan depresi adalah
berhubungan dengan bunuh diri. J Psychiatr Res 2008, 42:151�157.
69. Rao JS, Harry GJ, Rapoport SI, Kim HW: Meningkatnya eksotoksisitas dan
marker neuroinflammatory pada korteks frontal postmortem dari bipolar
pasien gangguan. Psikiatri Mol 2010, 15:384�392.
70. Bernstein HG, Steiner J, Bogerts B: Sel glial pada skizofrenia:
signifikansi patofisiologis dan kemungkinan konsekuensi terapi.
Pakar Rev Neurother 2009, 9:1059�1071.
71. Chen SK, Tvrdik P, Peden E, Cho S, Wu S, Spangrude G, Capecchi MR:
Hematopoietik asal perawatan patologis pada tikus mutan HoxbXNX.
Sel 2010, 141:775�785.
72. Antony JM: Grooming dan berkembang dengan mikroglia. Sinyal Sci 2010, 3: jc8.
73. Wonodi I, Stine OC, Sathyasaikumar KV, Roberts RC, Mitchell BD, Hong LE,
Kajii Y, Thaker GK, Schwarcz R: Turunkan kynurenin 3-
ekspresi gen monooxygenase dan aktivitas enzim pada skizofrenia
dan hubungan genetik dengan endofenotip skizofrenia. Arch Gen
Psikiatri 2011, 68:665�674.
74. Raison CL, Lowry CA, Rook GA: Peradangan, sanitasi, dan
Kekhawatiran: kehilangan kontak dengan coevolved, tolerogenic
mikroorganisme dan patofisiologi dan pengobatan mayor
depresi. Arch Gen Psychiatry 2010, 67:1211�1224.
75. Drexhage RC, Hoogenboezem TH, Versnel MA, Berghout A, Nolen WA,
Drexhage HA: Aktivasi jaringan sel monosit dan T pada pasien
dengan gangguan bipolar. Brain Behav Immun 2011, 25:1206�1213.
76. Steiner J, Jacobs R, Panteli B, Brauner M, Schiltz K, Bahn S, Herberth M,
Westphal S, Gos T, Walter M, Bernstein HG, Myint AM, Bogerts B: Akut
Skizofrenia disertai dengan penurunan sel T dan peningkatan sel B
kekebalan. Eur Arch Psychiatry Clin Neurosci 2010, 260:509�518.
77. Rotge JY, Aouizerate B, Tignol J, Bioulac B, Burbaud P, Guehl D: The
hipotesis kekebalan genetik berbasis glutamat dalam obsesif-kompulsif
gangguan, Pendekatan integratif dari gen terhadap gejala.
Ilmu Saraf 2010, 165:408�417.
78. Y�ksel C, Ong�r D: Studi spektroskopi resonansi magnetik
kelainan glutamat terkait gangguan mood. Biol Psychiatry 2010,
68: 785 794.
79. Rao JS, Kellom M, EA Reese, Rapoport SI, Kim HW: Disambiguasi glutamat
dan transporter dopamin di korteks frontal postmortem dari bipolar
dan pasien skizofrenia. J Affect Disord 2012, 136:63�71.
80. Bauer D, Gupta D, Harotunian V, Meador-Woodruff JH, McCullumsmith RE:
Ekspresi abnormal transporter dan transporter glutamat
berinteraksi molekul di korteks prefrontal pada pasien usia lanjut dengan
skizofrenia. Schizophr Res 2008, 104:108�120.
81. Matute C, Melone M, Vallejo-Illarramendi A, Conti F: Ekspresi meningkat
dari transporter glutamat astrositik GLT-1 di korteks prefrontal
penderita skizofrenia. 2005, 49:451�455.
82. Smith RE, Haroutunian V, Davis KL, Meador-Woodruff JH: Ekspresi
transkrip transpor pengangkut asam amino di thalamus subjek
dengan skizofrenia. Am J Psikiatri 2001, 158:1393�1399.
83. McCullumsmith RE, Meador-Woodruff JH: Asam amino rangsang striatal
Ekspresi transkrip transporter pada skizofrenia, gangguan bipolar,
dan gangguan depresi mayor. Neuropsychopharmacology 2002,
26: 368 375.
84. Pittenger C, Bloch MH, Williams K: Kelainan glutamat pada obsesif
gangguan kompulsif: neurobiologi, patofisiologi, dan pengobatan.
Farmakol Ada 2011, 132:314�332.
85. Hashimoto K: Muncul peran glutamat dalam patofisiologi
gangguan depresi mayor. Brain Res Rev 2009, 61:105�123.
86. Hashimoto K, Sawa A, Iyo M: Peningkatan kadar glutamat dalam otak
pasien dengan gangguan mood. Biol Psikiatri 2007, 62:1310�1316.
87. Burbaeva G, Boksha IS, Turishcheva MS, EA Vorobyeva, Savushkina OK,
Tereshkina EB: Glutamin sintetase dan glutamat dehidrogenase di Indonesia
korteks prefrontal pasien dengan skizofrenia. Prog
Neuropsychopharmacol Biol Psikiatri 2003, 27:675�680.
88. Bhattacharyya S, Khanna S, Chakrabarty K, Mahadevan A, Christopher R,
Shankar SK: autoantibodi anti-otak dan rangsang yang berubah
neurotransmitter dalam gangguan obsesif-kompulsif.
Neuropsikofarmakologi 2009, 34:2489�2496.
89. Sanacora G, Gueorguieva R, Epperson CN, Wu YT, Appel M, Rothman DL,
Krystal JH, Mason GF: Perubahan gammaaminobutyric spesifik subtipe
asam dan glutamat pada pasien dengan depresi berat.
Arch Gen Psikiatri 2004, 61:705�713.
90. Marsman A, van den Heuvel MP, Klomp DW, Kahn RS, Luijten PR, Hulshoff
Pol D: Glutamat pada skizofrenia: tinjauan terfokus dan meta analisis
studi 1H-MRS. Schizophr Bull 2013, 39:120�129.
91. Liu Y, Ho RC, Mak A: Interleukin (IL) -6, tumor necrosis factor alpha
(TNF-alfa) dan reseptor interleukin-2 terlarut (sIL-2R) meningkat pada
pasien dengan gangguan depresi mayor: meta-analisis dan metaregresi.
J Mempengaruhi Gangguan 2012, 139:230�239.
92. Brietzke E, Stabellini R, Grassis-Oliveira R, Lafer B: Sitokin di bipolar
Gangguan: temuan baru-baru ini, efek merusak tapi menjanjikan masa depan
terapi. Spektrum SSP 2011. www.cnsspectrums.com/aspx/
articledetail.aspx? articleid = 3596.
93. Denys D, Fluitman S, Kavelaars A, Heijnen C, Westenberg H: Turun
Aktivitas TNF-alfa dan NK dalam gangguan obsesif-kompulsif.
Psikoneuroendokrinologi 2004, 29:945�952.
94. Brambilla F, Perna G, Bellodi L, Arancio C, Bertani A, Perini G, Carraro C, Gava
F: Plasma interleukin-1 beta dan konsentrasi faktor tumor nekrosis di Indonesia
gangguan obsesif-kompulsif. Biol Psikiatri 1997, 42:976�981.
95. Fluitman S, Denys D, Vulink N, Schutters S, Heijnen C, Westenberg H:
Produksi sitokin yang diinduksi lipopolisakarida secara obsesifkompulsif
gangguan dan gangguan kecemasan sosial umum. Psikiatri
Resolusi 2010, 178:313�316.
96. Janelidze S, Mattei D, Westrin A, Traskman-Bendz L, Brundin L: Sitokin
Tingkat darah bisa membedakan usaha bunuh diri dengan depresi
pasien. Brain Behav Immun 2011, 25:335�339.
97. Pos M, Costallat LT, Appenzeller S: Manifestasi neuropsikiatrik di Indonesia
lupus eritematosus sistemik: epidemiologi, patofisiologi dan
pengelolaan. Obat CNS 2011, 25:721�736.
98. Kozora E, Hanly JG, Lapteva L, Filley CM: Disfungsi kognitif di
lupus eritematosus sistemik: masa lalu, sekarang, dan masa depan.
Radang Sendi Rheum 2008, 58:3286�3298.
99. Lancaster E, Martinez-Hernandez E, Dalmau J: Ensefalitis dan antibodi terhadap
protein permukaan sel sinaptik dan neuron. Neurologi 2011, 77:179�189.
100. Dalmau J, Lancaster E, Martinez-Hernandez E, Rosenfeld MR, Balice-Gordon
R: Pengalaman klinis dan pemeriksaan laboratorium pada pasien dengan antiNMDAR
radang otak. Lancet Neurol 2011, 10:63�74.
101. Lai M, Huijbers MG, Lancaster E, Graus F, Bataller L, Balice-Gordon R, Cowell
JK, Dalmau J: Investigasi LGI1 sebagai antigen dalam ensefalitis limbik
sebelumnya dikaitkan dengan saluran potasium: rangkaian kasus. Lancet Neurol
2010, 9:776-785.
102. Lancaster E, Huijbers MG, Bar V, Boronat A, Wong A, Martinez-Hernandez E,
Wilson C, Jacobs D, Lai M, Walker RW, Graus F, Bataller L, Illa I, Markx S, Strauss
KA, Peles E, Scherer SS, Dalmau J: Investigasi caspr2, sebuah autoantigen dari
ensefalitis dan neuromyotonia. Ann Neurol 2011, 69:303�311.
103. Lancaster E, Lai M, Peng X, Hughes E, Constantinescu R, Raizer J, Friedman
D, Skeen MB, Grisold W, Kimura A, Ohta K, Iizuka T, Guzman M, Graus F,
Moss SJ, Balice-Gordon R, Dalmau J: Antibodi terhadap reseptor GABA (B) di
ensefalitis limbik dengan kejang: rangkaian kasus dan karakterisasi
antigen. Lancet Neurol 2010, 9:67�76.
104. Lancaster E, Martinez-Hernandez E, Titulaer MJ, Boulos M, Weaver S, Antoine
JC, Liebers E, Kornblum C, Bien CG, Honnorat J, Wong S, Xu J, Kontraktor A,
Balice-Gordon R, Dalmau J: Antibodi untuk glutamat metabotropik
reseptor 5 pada sindrom Ophelia. Neurologi 2011, 77:1698�1701.105. Ances BM, Vitaliani R, Taylor RA, Liebeskind DS, Voloschin A, Houghton DJ,
Galetta SL, Dichter M, Alavi A, Rosenfeld MR, Dalmau J: Pengobatan responsif
ensefalitis limbik yang diidentifikasi oleh antibodi neuropil: MRI dan
korelasi PET. Otak 2005, 128:1764�1777.
106. Tofaris GK, SR Irani, Cheeran BJ, Baker IW, Cader ZM, Vincent A:
Klinik imunologis responsif sebagai fitur penyajian LGI1-
ensefalitis antibodi. Neurologi 2012, 79:195�196.
107. Najjar S, Pearlman D, Najjar A, Gilaian V, Zagzag D, Devinsky O:
Ensefalitis autoimun ekstrinsik disertai dengan asam glutamat
Antibodi dekarboksilase: entitas yang kurang terdiagnosis? Epilepsi Behav
2011, 21:306-313.
108. Titulaer MJ, McCracken L, Gabilondo I, T Armangue, Glaser C, Iizuka T, Honig
LS, Benseler SM, Kawachi I, Martinez-Hernandez E, Aguilar E, Gresa-Arribas N,
Ryan-Florance N, Torrents A, Saiz A, Rosenfeld MR, Balice-Gordon R, Graus F,
Dalmau J: Faktor pengobatan dan prognostik untuk hasil jangka panjang di
pasien dengan ensefalitis reseptor anti-NMDA: kelompok observasional
belajar. Lancet Neurol 2013, 12:157�165.
109. Dalmau J, Gleichman AJ, Hughes EG, Rossi JE, Peng X, Lai M, Dessain SK,
Rosenfeld MR, Balice-Gordon R, Lynch DR: Reseptor anti-NMDA
ensefalitis: rangkaian kasus dan analisis efek antibodi.
Lancet Neurol 2008, 7:1091�1098.
110. Graus F, Boronat A, Xifro X, Boix M, Svigelj V, Garcia A, Palomino A, Sabater
L, Alberch J, Saiz A: Profil klinis perluasan reseptor anti-AMPA
radang otak. Neurologi 2010, 74:857�859.
111. Lai M, Hughes EG, Peng X, Zhou L, Gleichman AJ, Shu H, Mata S, Kremens
D, Vitaliani R, Geschwind MD, Bataller L, Kalb RG, Davis R, Graus F, Lynch DR,
Balice-Gordon R, Dalmau J: Antibodi reseptor AMPA dalam keadaan limbik
ensefalitis mengubah lokasi reseptor sinaptik. Ann Neurol 2009, 65:424�434.
112. Najjar S, Pearlman D, Devinsky O, Najjar A, Nadkarni S, Butler T, Zagzag D:
Neuropsychiatric autoimun ensefalitis dengan kompleks VGKC negatif,
NMG, dan autoantibodi GAD: laporan kasus dan tinjauan pustaka,
yang akan datang Cogn Behav Neurol. di tekan
113. Najjar S, Pearlman D, Zagzag D, Devinsky O: Secara spontan menyelesaikan
ensefalitis limbik autoimun seronegatif. Cogn Behav Neurol 2011,
24: 99 105.
114. Gabilondo I, Saiz A, Galan L, Gonzalez V, Jadraque R, Sabater L, Sans A,
Sempere A, Vela A, Villalobos F, Vials M, Villoslada P, Graus F: Analisis
kambuh pada ensefalitis anti-NMDAR. Neurologi 2011, 77:996�999.
115. Barry H, Hardiman O, Healy DG, Keogan M, Moroney J, Molnar PP, Cotter
DR, Murphy KC: Ensefalitis reseptor anti-NMDA: penting
diagnosis banding pada psikosis. Br J Psikiatri 2011, 199:508�509.
116. Dickerson F, Stallings C, Vaughan C, Origoni A, Khushalani S, Yolken R:
Antibodi terhadap reseptor glutamat di mania. Bipolar Disord 2012,
14: 547 553.
117. O'Loughlin K, Ruge P, McCauley M: Ensefalitis dan skizofrenia: a
masalah kata-kata Br J Psychiatry 2012, 201: 74.
118. Parratt KL, Allan M, Lewis SJ, Dalmau J, GM Halmagyi, Spies JM: Akut
penyakit kejiwaan pada seorang wanita muda: bentuk ensefalitis yang tidak biasa.
Med J Agustus 2009, 191:284�286.
119. Suzuki Y, Kurita T, Sakurai K, Takeda Y, Koyama T: Laporan kasus anti-NMDA
ensefalitis reseptor dicurigai skizofrenia. Seishin Shinkeigaku
Zasshi 2009, 111:1479�1484.
120. Tsutsui K, Kanbayashi T, Tanaka K, Boku S, Ito W, Tokunaga J, Mori A,
Hishikawa Y, Shimizu T, Nishino S: antibodi anti-NMDA-reseptor terdeteksi
di ensefalitis, skizofrenia, dan narkolepsi dengan fitur psikotik.
BMC Psychiatry 2012, 12: 37.
121. Van Putten WK, Hachimi-Idrissi S, Jansen A, Van Gorp V, Huyghens L:
Jarang terjadi perilaku psikotik pada seorang gadis berusia 9: sebuah kasus
melaporkan. Laporan Kasus Med 2012, 2012: 358520.
122. Masdeu JC, Gonzalez-Pinto A, Matute C, Ruiz De Azua S, Palomino A, De
Leon J, Berman KF, Dalmau J: Antibodi IgG serum melawan NR1
subunit reseptor NMDA tidak terdeteksi pada skizofrenia. Am J
Psikiatri 2012, 169:1120�1121.
123. Kirvan CA, Swedo SE, Kurahara D, Cunningham MW: Mimikri streptokokus
dan pensinyalan sel yang dimediasi antibodi dalam patogenesis
Korea Sydenham. Autoimunitas 2006, 39:21�29.
124. Swedo SE: Infeksi streptokokus, sindrom Tourette, dan OCD: ada di sana
koneksi? Panda: Kuda atau Zebra? Neurologi 2010, 74:1397�1398.
125. Morer A, Lazaro L, Sabater L, Massana J, Castro J, Graus F: Antineuronal
antibodi pada sekelompok anak dengan gangguan obsesif-kompulsif
dan sindrom Tourette. J Psychiatr Res 2008, 42:64�68.
126. Pavone P, Bianchini R, Parano E, Incorpora G, Rizzo R, Mazzone L, Trifiletti RR:
Antibodi anti-otak pada PANDAS versus streptococcal tanpa komplikasi
infeksi. Pediatr Neurol 2004, 30:107�110.
127. Maina G, Albert U, Bogetto F, Borghese C, Berro AC, Mutani R, Rossi F,
Vigliani MC: Antibodi anti-otak pada pasien dewasa dengan obsessivecompulsive
kekacauan. J Affect Disord 2009, 116:192�200.
128. Brimberg L, Benhar I, Mascaro-Blanco A, Alvarez K, Lotan D, Winter C, Klein J,
Moses AE, Somnier FE, Leckman JF, Swedo SE, Cunningham MW, Joel D:
Kelainan perilaku, farmakologis, dan imunologis setelah
paparan streptokokus: model tikus baru dari korea Sydenham dan
gangguan neuropsikiatri terkait Neuropsychopharmacology 2012,
37: 2076 2087.
129. Dale RC, Candler PM, AJ Gereja, Tunggu R, Pocock JM, Giovannoni G:
Enzim glikolitik permukaan Neuronal adalah target autoantigen di
penyakit SSP autoimun post streptococcal. J Neuroimmunol 2006,
172: 187 197.
130. Nicholson TR, Ferdinando S, Krishnaiah RB, Anhoury S, Lennox BR, MataixCols
D, Cleare A, DM Veale, Drummond LM, Fineberg NA, Gereja AJ,
Giovannoni G, Heyman I: Prevalensi antibodi ganglia anti-basal di Indonesia
gangguan obsesif-kompulsif dewasa: penelitian cross-sectional. Br J Psychiatry
2012, 200:381-386.
131. Wu K, Hanna GL, Rosenberg DR, Arnold PD: Peran glutamat
menandakan dalam patogenesis dan pengobatan obsesif-kompulsif
kekacauan. Pharmacol Biochem Perilaku 2012, 100:726�735.
132. Perlmutter SJ, Leitman SF, Garvey MA, Hamburger S, Feldman E, Leonard
HL, Swedo SE: Pertukaran plasma terapeutik dan intravena
imunoglobulin untuk gangguan obsesif kompulsif dan gangguan tic di
masa kanak-kanak. Lancet 1999, 354:1153�1158.
133. Pereira A Jr, Furlan FA: Astrosit dan kognisi manusia: pemodelan
integrasi informasi dan modulasi aktivitas neuron.
Prog Neurobiol 2010, 92:405�420.
134. Barre BA: Misteri dan keajaiban glia: perspektif tentang peran mereka
kesehatan dan penyakit. Neuron 2008, 60:430�440.
135. Verkhratsky A, Parpura V, Rodriguez JJ: Dimana pikiran tinggal:
fisiologi neuronal-glial "jaring saraf yang menyebar". Brain Res Rev 2011,
66: 133 151.
136. Sofroniew MV: Pembedahan molekuler astrogliosis reaktif dan bekas luka glial
pembentukan. Tren Neurosci 2009, 32:638�647.
137. Hamilton NB, Attwell D: Apakah astrosit benar-benar melakukan eksotitas pada neurotransmiter?
Nat Rev Neurosci 2010, 11:227�238.
138. Rajkowska G: Studi postmortem pada gangguan mood mengindikasikan perubahan
jumlah neuron dan sel glia. Biol Psikiatri 2000, 48:766�777.
139. Coupland NJ, Ogilvie CJ, Hegadoren KM, Seres P, Hanstock CC, Allen PS:
Mengurangi prefrontal Myo-inositol dalam gangguan depresi mayor.
Biol Psikiatri 2005, 57:1526�1534.
140. Miguel-Hidalgo JJ, Overholser JC, Jurjus GJ, Meltzer HY, Dieter L, Konick L,
Stockmeier CA, Rajkowska G: Imunoterapi imunokuler dan ekstravaskular
untuk molekul adhesi interselular 1 dalam korteks orbitofrontal
subjek dengan depresi berat: perubahan yang bergantung pada usia. J Mempengaruhi Disord
2011, 132:422-431.
141. Miguel-Hidalgo JJ, Wei JR, Andrew M, Overholser JC, Jurjus G, Stockmeier
CA, Rajkowska G: Glia patologi di korteks prefrontal dalam alkohol
ketergantungan dengan dan tanpa gejala depresi. Biol Psychiatry 2002,
52: 1121 1133.
142. Stockmeier CA, Mahajan GJ, Konick LC, Overholser JC, Jurjus GJ, Meltzer HY,
Uylings HB, Friedman L, Rajkowska G: Perubahan seluler pada postmortem
hipokampus dalam depresi berat. Biol Psikiatri 2004, 56:640�650.
143. Ong�r D, Drevets WC, Price JL: Pengurangan glial di prefrontal subgenual
korteks pada gangguan mood. Proc Natl Acad Sci USA 1998, 95:13290�13295.
144. Gittins RA, Harrison PJ: Studi morfometri glia dan neuron di
korteks anterior cingulate dalam gangguan mood. J Mempengaruhi Disord 2011,
133: 328 332.
145. Cotter D, Mackay D, Beasley C, Kerwin R, Everall I: Mengurangi kerapatan glial
dan volume neuron dalam gangguan depresi mayor dan skizofrenia di Indonesia
korteks cingulate anterior [abstrak]. Skizofrenia Res 2000, 41: 106.
146. Si X, Miguel-Hidalgo JJ, Rajkowska G: Ekspresi GFAP berkurang di
Korteks prefrontal dorsolateral dalam depresi. Dalam Society for Neuroscience; 2003.
Pertemuan Neuroscience Planne: New Orleans; 2003.
147. Legutko B, Mahajan G, Stockmeier CA, Rajkowska G: astrosit zat putih
berkurang dalam depresi. Dalam Society for Neuroscience. Pertemuan Ilmu Saraf
Perencana: Washington, DC; 2011.148. Edgar N, Sibille E: Peran fungsional putatif untuk oligodendrosit di Indonesia
pengaturan mood Transl Psychiatry 2012, 2: e109.
149. Rajkowska G, Halaris A, Selemon LD: Penurunan neuronal dan glial
kerapatan mengkarakterisasi korteks prefrontal dorsolateral di bipolar
kekacauan. Biol Psikiatri 2001, 49:741�752.
150. Cotter D, Mackay D, Chana G, Beasley C, Landau S, Everall IP: Dikurangi
ukuran neuron dan kerapatan sel glial di daerah 9 dorsolateral
korteks prefrontal pada subjek dengan gangguan depresi mayor. Cereb Cortex
2002, 12:386-394.
151. Stark AK, Uylings HB, Sanz-Arigita E, Pakkenberg B: Hilangnya sel Glial di
korteks cingulate anterior, subregional korteks prefrontal, di
subyek dengan skizofrenia. Am J Psikiatri 2004, 161:882�888.
152. Konopaske GT, Dorph-Petersen KA, Sweet RA, Pierri JN, Zhang W, Sampson
AR, Lewis DA: Pengaruh paparan antipsikotik kronis pada astrosit dan
jumlah oligodendrosit pada monyet kera. Biol Psychiatry 2008,
63: 759 765.
153. Selemon LD, Lidow MS, Goldman-Rakic PS: Meningkat volume dan glial
kepadatan pada korteks prefrontal primata yang berhubungan dengan kronis
paparan obat antipsikotik. Biol Psikiatri 1999, 46:161�172.
154. Steiner J, Bernstein HG, Bielau H, Farkas N, Winter J, Dobrowolny H, Brisch R,
Gos T, Mawrin C, Myint AM, Bogerts B: S100B-glukosa imunopositif adalah
meningkat dalam paranoid dibandingkan dengan skizofrenia residual: a
studi morfometri. J Psychiatr Res 2008, 42:868�876.
155. Carter CJ: eIF2B dan kelangsungan hidup oligodendrocyte: dimana alam dan pengasuhan
bertemu dengan gangguan bipolar dan skizofrenia? Schizophr Bull 2007,
33: 1343 1353.
156. Hayashi Y, Nihonmatsu-Kikuchi N, Hisanaga S, Yu XJ, Tatebayashi Y:
Kesamaan neuropatologis dan perbedaan antara skizofrenia
dan gangguan bipolar: sebuah studi otak postmortem aliran cytometric.
PLoS One 2012, 7: e33019.
157. Uranova NA, Vikhreva OV, Rachmanova VI, Orlovskaya DD: Ultrastruktur
perubahan serat myelinated dan oligodendrocytes di prefrontal
korteks pada skizofrenia: sebuah studi morfometrik postmortem.
Perawatan Kompresi Schizophr 2011, 2011: 325789.
158. Torres-Platas SG, Hercher C, Davoli MA, Maussion G, Labonte B, Turecki
G, Mechawar N: Hipertrofi astrositik pada cingulate anterior putih
masalah tertekan bunuh diri Neuropsychopharmacology 2011,
36: 2650 2658.
159. Pereira A Jr, Furlan FA: Peran sinkron untuk neuron-astrosit
interaksi dan persepsi proses sadar. J Biol Phys 2009,
35: 465 480.
160. Kettenmann H, Hanisch UK, Noda M, Verkhratsky J: Fisiologi dari
mikroglia. Physiol Rev 2011, 91:461�553.
161. Tremblay ME, Stevens B, Sierra A, Wake H, Bessis A, Nimmerjahn A: Perannya
mikroglia di otak yang sehat. J Neurosci 2011, 31:16064�16069.
162. Kaindl AM, Degos V, Peineau S, Gouadon E, Chhor V, Loron G, Le
Charpentier T, Josserand J, Ali C, Vivien D, Collingridge GL, Lombet A, Issa L,
Rene F, Loeffler JP, Kavelaars A, Verney C, Mantz J, Gressens P: Aktivasi dari
Reseptor N-methyl-D-aspartate mikroglial memicu peradangan dan
kematian sel neuron di otak berkembang dan matang. Ann Neurol
2012, 72:536-549.
163. Schwartz M, Shaked I, Fisher J, Mizrahi T, Schori H: Pelindung
autoimmunity melawan musuh dalam: melawan toksisitas glutamat.
Tren Neurosci 2003, 26:297�302.
164. Pacheco R, Gallart T, Lluis C, Franco R: Peran glutamat pada sel T.
kekebalan yang dimediasi. J Neuroimmunol 2007, 185:9�19.
165. Najjar S, Pearlman D, Miller DC, Devinsky O: Refraktori epilepsi yang terkait
dengan aktivasi mikroglial. Neurolog 2011, 17:249�254.
166. Schwartz M, Butovsky O, Bruck W, Hanisch UK: Fenotipe mikroglial: adalah
komitmen dapat dibalik? Tren Neurosci 2006, 29:68�74.
167. Wang F, Wu H, Xu S, Guo X, Yang J, Shen X: Migrasi makrofag
Faktor penghambat mengaktifkan protein 2-prostaglandin E2 cyclooxygenase dalam proses budidaya
mikroglia tulang belakang. Neurosci Res 2011, 71:210�218.
168. Zhang XY, Xiu MH, Song C, Chenda C, Wu GY, Haile CN, Kosten TA, Kosten
TR: Peningkatan serum S100B tanpa obat dan obat
pasien skizofrenia. J Psychiatr Res 2010, 44:1236�1240.
169. Kawasaki Y, Zhang L, Cheng JK, Ji RR: Mekanisme sitokin sentral
sensitisasi: peran interleukin-1beta yang berbeda dan saling tumpang tindih,
interleukin-6, dan tumor necrosis factor-alpha dalam mengatur sinapsis dan
Aktivitas neuron di sumsum tulang belakang dangkal. J Neurosci 2008,
28: 5189 5194.
170. Müller N, Schwarz MJ. Dasar imunologi glutamatergik
gangguan pada skizofrenia: menuju pandangan terpadu. J Neural
Suplai Transm 2007, 72:269�280.
171. Hestad KA, Tonseth S, Stoen CD, Ueland T, Aukrust P: Tingkat plasma yang meningkat
Faktor nekrosis tumor alpha pada pasien dengan depresi: normalisasi
selama terapi elektrokonvulsif. J ECT 2003, 19:183�188.
172. Kubera M, Kenis G, Bosmans E, Zieba A, Dudek D, Nowak G, Maes M:
Tingkat plasma interleukin-6, interleukin-10, dan interleukin-1 receptor
antagonis dalam depresi: perbandingan antara keadaan akut dan sesudahnya
pengampunan. Pol J Pharmacol 2000, 52:237�241.
173. Miller BJ, Buckley P, Seabolt W, Mellor A, Kirkpatrick B: Meta-analisis dari
Perubahan sitokin pada skizofrenia: status klinis dan antipsikotik
efek. Biol Psikiatri 2011, 70:663�671.
174. Potvin S, Stip E, Sepehry AA, Gendron A, Bah R, Kouassi E: Peradangan
Perubahan sitokin pada skizofrenia: tinjauan kuantitatif sistematis.
Biol Psikiatri 2008, 63:801�808.
175. Reale M, Patruno A, De Lutiis MA, Pesce M, Felaco M, Di Giannantonio M, Di
Nicola M, Grilli A: Disregulasi produksi kemo-sitokin di
pasien skizofrenia versus kontrol sehat. BMC Neurosci 2011, 12: 13.
176. Fluitman SB, Denys DA, Heijnen CJ, Westenberg HG: Jijik mempengaruhi TNFalpha,
IL-6 dan noradrenalin pada pasien dengan obsesif-kompulsif
kekacauan. Psikoneuroendokrinologi 2010, 35:906�911.
177. Konuk N, Tekin IO, Ozturk U, Atik L, Atasoy N, Bektas S, Erdogan J: Plasma
Tingkat faktor nekrosis tumor-alpha dan interleukin-6 secara obsesif
gangguan kompulsif Mediator Inflamm 2007, 2007: 65704.
178. Monteleone P, Catapano F, Fabrazzo M, Tortorella A, Maj M: Turun
tingkat tumor tumor nekrosis faktor-alfa pada pasien dengan obsessivecompulsive
kekacauan. Neuropsikobiologi 1998, 37:182�185.
179. Marazziti D, Presta S, Pfanner C, Gemignani A, Rossi A, Sbrana S, Rocchi V,
Ambrogi F, Cassano GB: Perubahan imunologi pada obsesifekompulsif dewasa
kekacauan. Biol Psikiatri 1999, 46:810�814.
180. Zai G, Arnold PD, Burroughs E, Richter MA, Kennedy JL: Tumor nekrosis
Gen faktor-alpha tidak terkait dengan gangguan obsesif-kompulsif.
Psikiater Genet 2006, 16: 43.
181. Rodr�guez AD, Gonz�lez PA, Garc�a MJ, de la Rosa A, Vargas M, Marrero F:
Variasi sirkadian pada konsentrasi sitokin proinflammatory secara akut
infark miokard. Rev Esp Cardiol 2003, 56:555�560.
182. Oliver JC, LA Bland, Oettinger CW, Arduino MJ, McAllister SK, Aguero SM,
Favero MS: Kinetika sitokin dalam model darah utuh in vitro berikut
tantangan endotoksin. Limfokin Sitokin Res 1993, 12:115�120.
183. Le T, Leung L, Carroll WL, Schibler KR: Regulasi gen interleukin-10
Ekspresi: mekanisme yang memungkinkan untuk menghitung upregulasi dan untuknya
Perbedaan maturasi dalam ekspresinya oleh sel mononuklear darah.
Darah 1997, 89:4112�4119.
184. Lee MC, Ting KK, Adams S, Pak BJ, Chung R, Guillemin GJ:
Karakterisasi ekspresi reseptor NMDA pada manusia
astrosit PLoS One 2010, 5: e14123.
185. Myint AM, Kim YK, Verkerk R, Scharpe S, Steinbusch H, Leonard B:
Jalur kynurenine dalam depresi berat: bukti gangguan
pelindung saraf. J Affect Disord 2007, 98:143�151.
186. Sanacora G, Treccani G, Popoli M: Menuju hipotesis glutamat
depresi: sebuah perbatasan baru neuropsychopharmacology untuk
gangguan suasana hati. Neurofarmakologi 2012, 62:63�77.
187. Saleh A, Schroeter M, Jonkmanns C, Hartung HP, Modder U, Jander S: Di
vivo MRI peradangan otak pada stroke iskemik manusia. Brain 2004,
127: 1670 1677.
188. Tilleux S, Hermans E: Neuroinflamasi dan regulasi glial glutamat
penyerapan pada gangguan neurologis. J Neurosci Res 2007, 85:2059�2070.
189. Helms HC, Madelung R, Waagepetersen HS, Nielsen CU, Brodin B: In vitro
bukti hipotesis glutamat penghilang glutamat: otak endothelial
Sel yang dikompilasi dengan astrocytes menampilkan polarisasi otak-ke-darah
transportasi glutamat. 2012, 60:882�893.
190. Leonard BE: Konsep depresi sebagai disfungsi kekebalan tubuh
sistem. Curr Immunol Rev 2010, 6:205�212.
191. Labrie V, Wong AH, Roder JC: Kontribusi jalur D-serine untuk
skizofrenia. Neurofarmakologi 2012, 62:1484�1503.
192. Gras G, Samah B, Hubert A, C Leone, Porcheray F, Rimaniol AC: EAAT
ekspresi oleh makrofag dan mikroglia: masih lebih banyak pertanyaan daripada
jawaban. Asam Amino 2012, 42:221�229.
193. Livingstone PD, Dickinson JA, Srinivasan J, Kew JN, Wonnacott S:
Glutamat-dopamin crosstalk di korteks prefrontal tikus dimodulasi oleh reseptor nikotin Alpha7 dan diperkuat oleh PNU-120596. J Mol
Neurosci 2010, 40:172�176.194. Kondziella D, Brenner E, Eyjolfsson EM, Sonnewald U: Bagaimana glialneuronal
interaksi sesuai dengan hipotesis neurotransmiter terkini
skizofrenia? Neurochem Int 2007, 50:291�301.
195. Wu HQ, Pereira EF, Bruno JP, Pellicciari R, Albuquerque EX, Schwarcz R: The
antagonis reseptor nikotinik yang diturunkan dari astrosit
mengendalikan kadar glutamat ekstraseluler di korteks prefrontal. J Mol
Ilmu Saraf 2010, 40:204�210.
196. Steiner J, Bogerts B, Schroeter ML, Bernstein HG: protein S100B di
gangguan neurodegeneratif. Clin Chem Lab Med 2011, 49:409�424.
197. Steiner J, Marquardt N, Pauls, Schiltz K, Rahmoune H, Bahn S, Bogerts B,
Schmidt RE, Jacobs R: Sel CD8 (+) manusia dan sel NK mengekspresikan dan
mensekresi S100B pada saat stimulasi. Brain Behav Immun 2011, 25:1233�1241.
198. Shanmugam N, Kim YS, Lanting L, Natarajan R: Peraturan PT
Ekspresi siklooksigenase-2 pada monosit oleh ligasi reseptor
untuk produk akhir glikasi lanjut. J Biol Chem 2003, 278:34834�34844.
199. Rothermundt M, Ohrmann P, Abel S, Siegmund A, Pedersen A, Ponath G,
Suslow T, Peters M, Kaestner F, Heindel W, Arolt V, Pfleiderer B: sel Glial
aktivasi pada subkelompok pasien dengan skizofrenia yang ditunjukkan oleh
peningkatan konsentrasi serum S100B dan peningkatan myo-inositol.
Prog Neuropsychopharmacol Biol Psikiatri 2007, 31:361�364.
200. Falcone T, Fazio V, Lee C, Simon B, Franco K, Marchi N, Janigro D: Serum
S100B: biomarker potensial untuk suicidality pada remaja? PLoS One
2010, 5: e11089.
201. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: Serum
Penanda mendukung patologi glial spesifik penyakit dalam depresi berat.
J Mempengaruhi Gangguan 2008, 111:271�280.
202. Rothermundt M, Ahn JN, Jorgens S: S100B dalam skizofrenia: sebuah update.
Gen Physiol Biophys 2009, 28 Spesifikasi Tanpa Fokus:F76�F81.
203. Schroeter ML, Abdul-Khaliq H, Krebs M, Diefenbacher A, Blasig IE: Neuronspesifik
enolase tidak berubah sedangkan S100B meningkat dalam serum
penelitian asli dan meta-analisis skizofrenia.
Psikiatri Res 2009, 167:66�72.
204. Rothermundt M, Missler U, Arolt V, Peters M, Leadbeater J, Wiesmann M,
Rudolf S, Wandinger KP, Kirchner H: Meningkatnya kadar S100B di Indonesia
Pasien skizofrenia yang tidak berpendidikan dan dirawat berkorelasi dengan
gejala negatif. Psikiatri Mol 2001, 6:445�449.
205. Suchankova P, Klang J, Cavanna C, Holm G, Nilsson S, Jonsson EG, Ekman A:
Apakah polimorfisme Gly82Ser pada gen RAGE relevan dengan
skizofrenia dan sifat kepribadian psikoterapis? J Psychiatry Neurosci
2012, 37:122-128.
206. Scapagnini G, Davinelli S, Drago F, De Lorenzo A, Oriani G: Antioksidan sebagai
antidepresan: fakta atau fiksi? Obat CNS 2012, 26:477�490.
207. Ng F, Berk M, Dean O, Bush AI: Stres oksidatif pada gangguan kejiwaan:
bukti dasar dan implikasi terapeutik. Int J Neuropsychopharmacol
2008, 11:851-876.
208. Salim S, Chugh G, Asghar M: Peradangan dalam kegelisahan. Adv Protein Chem
Struktur Biol 2012, 88:1�25.
209. Anderson G, Berk M, Dodd S, Bechter K, AC Altamura, Dell'osso B, Kanba S,
Monji A, Fatemi SH, Buckley P, Debnath M, Das UN, Meyer U, Müller N,
Kanchanatawan B, Maes M: Imuno-inflamasi, oksidatif dan nitrosatif
stres, dan jalur neuroprogresif dalam etiologi, kursus dan pengobatan
skizofrenia. Prog Neuropsychopharmacol Biol Psychiatry 2013, 42:1�42.
210. Coughlin JM, Ishizuka K, Kano SI, Edwards JA, FT Seifuddin, Shimano MA,
Daley EL, dkk: Menandai pengurangan superoksida dismutase-1 terlarut
(SOD1) pada cairan serebrospinal pasien dengan onset baru-baru ini
skizofrenia. Psikiatri Mol 2012, 18:10�11.
211. Bombaci M, Grifantini R, Mora M, Reguzzi V, Petracca R, Meoni E, Balloni S,
Zingaretti C, Falugi F, Manetti AG, Margarit I, Musser JM, Cardona F, Orefici
G, Grandi G, Bensi G: Susunan protein profil penderita sera menunjukkan a
jangkauan luas dan respon imun yang meningkat terhadap Grup A
Antigen Streptococcus. PLoS One 2009, 4: e6332.
212. Valerio A, Cardile A, Cozzi V, Bracale R, Tedesco L, Pisconti A, Palomba L,
Cantoni O, Clementi E, Moncada S, Carruba MO, Nisoli E: TNF-alfa
merendahkan ekspresi eNOS dan biogenesis mitokondria dalam lemak
dan otot tikus obesitas. J Clin Investasikan 2006, 116:2791�2798.
213. Ott M, Gogvadze V, Orrenius S, Zhivotovsky B: Mitokondria, oksidatif
stres dan kematian sel. Apoptosis 2007, 12:913�922.
214. Shalev H, Serlin Y, Friedman A: Menembus penghalang darah-otak sebagai gerbang
untuk gangguan kejiwaan. Psikiatri Cardiovasc Neurol 2009, 2009: 278531.
215. Abbott NJ, Ronnback L, Hansson E: interaksi endotelial astrosit pada
penghalang darah-otak. Nat Rev Neurosci 2006, 7:41�53.
216. Bechter K, Reiber H, Herzog S, Fuchs D, Tumani H, Maxeiner HG:
Analisis cairan cerebrospinal pada spektrum afektif dan skizofrenia
Kelainan: identifikasi subkelompok dengan respon imun dan
disfungsi sawar darah-CSF. J Psychiatr Res 2010, 44:321�330.
217. Harris LW, Wayland M, Lan M, Ryan M, Giger T, Lockstone H, Wuethrich I,
Mimmack M, Wang L, Kotter M, Craddock R, Bahn S: Cerebral
microvasculature pada skizofrenia: studi mikrodesi pencitraan laser.
PLoS One 2008, 3: e3964.
218. Lin JJ, Mula M, Hermann BP: Mengungkap neurobehavioural
komorbiditas epilepsi selama umur. Lancet 2012, 380:1180�1192.
219. Isingrini E, Belzung C, Freslon JL, MC Machet, Camus V: Efek fluoxetine pada
vasorelaksinasi tergantung aorta nitrat oksida dalam tak terduga
model stres ringan kronis depresi pada tikus. Psychosom Med 2012,
74: 63 72.
220. Zhang XY, Zhou DF, Cao LY, Zhang PY, Wu GY, Shen YC: Efek dari
Pengobatan risperidone pada superoksida dismutase pada skizofrenia. J Clin
Psikofarmasi 2003, 23:128�131.
221. Lavoie KL, Pelletier R, Arsenault A, Dupuis J, Bacon SL: Asosiasi antara
depresi klinis dan fungsi endotel yang diukur dengan lengan bawah
reaktivitas hiperemik. Psikosom Med 2010, 72:20�26.
222. Chrapko W, Jurasz P, Radomski MW, Archer SL, Newman SC, Baker G, Lara N,
Le Melledo JM: Perubahan metabolit NO NO plasma dan
platelet NO aktivitas sintase oleh paroxetine pada pasien depresi.
Neuropsikofarmakologi 2006, 31:1286�1293.
223. Chrapko KAMI, Jurasz P, Radomski MW, Lara N, Archer SL, Le Melledo JM:
Berkurangnya aktivitas oksida nitrat oksida platelet dan oksida nitrat plasma
metabolit pada gangguan depresi mayor. Biol Psikiatri 2004, 56:129�134.
224. Stuehr DJ, Santolini J, Wang ZQ, Wei CC, Adak S: Update tentang mekanisme
dan regulasi katalitik dalam sintesis NO. J Biol Chem 2004,
279: 36167 36170.
225. Chen W, Druhan LJ, Chen CA, Hemann C, Chen YR, Berka V, Tsai AL, Zweier
JL: Peroksinitrit menginduksi penghancuran tetrahydrobiopterin dan
heme dalam sintesis nitrat oksida endothelial: transisi dari reversibel ke
penghambatan enzim yang ireversibel. Biokimia 2010, 49:3129�3137.
226. Chen CA, Wang TY, Varadharaj S, Reyes LA, Hemann C, Talukder MA, Chen
YR, Druhan LJ, Zweier JL: S-glutathionylation uncouples eNOS dan
mengatur fungsi seluler dan vaskularnya. Alam 2010, 468:1115�1118.
227. Szabo C, Ischiropoulos H, Radi R: Peroxynitrite: biokimia,
patofisiologi dan perkembangan terapi. Nat Rev Drug Discov
2007, 6:662-680.
228. Papakostas GI, Shelton RC, Zajecka JM, Etemad B, Rickels K, Clain A, Baer L,
Dalton ED, Sacco GR, Schoenfeld D, Pencina M, Meisner A, Bottiglieri T,
Nelson E, Mischoulon D, Alpert JE, Barbee JG, Zisook S, Fava M: Lmethylfolate
sebagai terapi tambahan untuk depresi berat resisten SSRI:
hasil dua percobaan acak, double-blind, paralel-sequential. Am J
Psikiatri 2012, 169:1267�1274.
229. Antoniades C, Shirodaria C, Warrick N, Cai S, de Bono J, Lee J, Leeson P,
Neubauer S, Ratnatunga C, Pillai R, Refsum H, Channon KM: 5-
methyltetrahydrofolate dengan cepat meningkatkan fungsi endotel dan
menurunkan produksi superoksida di pembuluh darah manusia: efek pada pembuluh darah
tetrahydrobiopterin dan sintesis nitrat oksida endotel
kopel. Sirkulasi 2006, 114:1193�1201.
230. Masano T, Kawashima S, Toh R, Satomi-Kobayashi S, Shinohara M, Takaya T,
Sasaki N, Takeda M, Tawa H, Yamashita T, Yokoyama M, Hirata K: Bermanfaat
efek tetrahydrobiopterin eksogen pada remodeling ventrikel kiri
Setelah infark miokard pada tikus: kemungkinan peran stres oksidatif
disebabkan oleh oksida nitrat sintase endotel. Circ J 2008,
72: 1512 1519.
231. Alp NJ, Channon KM: Peraturan sintesis nitrat oksida endotel oleh
tetrahydrobiopterin dalam penyakit vaskular. Arterioscler Thromb Vasc Biol 2004,
24: 413 420.
232. Szymanski S, Ashtari M, Zito J, G Degreef, Bogerts B, Lieberman J:
Gadolinium-DTPA meningkatkan gradien gema resonansi magnetik resonansi di
episode pertama psikosis dan pasien skizofrenia kronis.
Psikiatri Res 1991, 40:203�207.
233. Butler T, Weisholtz D, Isenberg N, Harding E, Epstein J, Stern E, Silbersweig
D: Neuroimaging disfungsi frontal-limbik pada skizofrenia dan
psikosis terkait epilepsi: menuju neurobiologi konvergen.
Epilepsi Perilaku 2012, 23:113�122.234. Butler T, Maoz A, Vallabhajosula S, Moeller J, Ichise M, Paresh K, Pervez F,
Friedman D, Goldsmith S, Najjar S, Osborne J, Solnes L, Wang X, French J,
Thesen T, Devinsky O, Kuzniecky R, Stern E, Silbersweig D: Pencitraan
peradangan pada pasien dengan epilepsi yang terkait dengan antibodi terhadap
asam glutamat dekarboksilase [abstrak]. Di Am Epilepsy Society Abstracts,
Volume 2. Baltimore: American Epilepsy Society; 2011: 191.
235. van Berckel BN, Bossong MG, Boellaard R, Kloet R, Schuitemaker A, Caspers
E, Luurtsema G, Windhorst AD, Cahn W, Lammertsma AA, Kahn RS:
Aktivasi Microglia dalam skizofrenia terkini: kuantitatif (R) -
[11C] Studi tomografi emisi positron PK11195. Biol Psychiatry 2008,
64: 820 822.
236. Doorduin J, de Vries EF, Willemsen AT, de Groot JC, Dierckx RA, Klein HC:
Neuroinflamasi pada psikosis terkait skizofrenia: sebuah studi PET.
J Nucl Med 2009, 50:1801�1807.
237. Takano A, Arakawa R, Ito H, Tateno A, Takahashi H, Matsumoto R, Okubo Y,
Suhara T: Reseptor benzodiazepin perifer pada pasien dengan penyakit kronis
skizofrenia: sebuah studi PET dengan [11C] DAA1106. Int J
Neuropsikofarmakol 2010, 13:943�950.
238. Müller N, Schwarz MJ, Dehning S, Douhe A, Cerovecki A, Goldstein-Muller B,
Spellmann I, Hetzel G, Maino K, Kleindienst N, Müller HJ, Arolt V, Riedel M:
Penghambat efek cyclooxygenase-2 celecoxib memiliki efek terapeutik pada
depresi berat: hasil double-blind, acak, plasebo
dikontrol, studi percontohan add-on untuk reboxetine. Mol Psikiatri 2006,
11: 680 684.
239. Akhondzadeh S, Jafari S, Raisi F, Nasehi AA, Ghoreishi A, Salehi B, MohebbiRasa
S, Raznahan M, Kamalipour A: Percobaan klinis dari selecoxib adjunctif
Pengobatan pada pasien dengan depresi berat: buta ganda dan
percobaan terkontrol plasebo. Menekan Kecemasan 2009, 26:607�611.
240. Mendlewicz J, Kriwin P, Oswald P, Souery D, Alboni S, Brunello N:
Permulaan timbulnya tindakan antidepresan dalam depresi berat menggunakan
augmentasi asam asetilalisilat: studi open-label percontohan. Int Clin
Psikofarmasi 2006, 21:227�231.
241. Uher R, Carver S, Power RA, Mors O, Maier W, Rietschel M, Hauser J,
Dernovsek MZ, Henigsberg N, Souery D, Placentino A, Petani A, McGuffin P:
Obat antiinflamasi non steroid dan khasiat antidepresan di Indonesia
gangguan depresi mayor. Psychol Med 2012, 42:2027�2035.
242. Müller N, Riedel M, Scheppach C, Brandstatter B, Sokullu S, Krampe K,
Ulmschneider M, Engel RR, Moller HJ, Schwarz MJ: Antipsikotik Bermanfaat
efek terapi add-on celecoxib dibandingkan dengan risperidone saja di
skizofrenia. Am J Psikiatri 2002, 159:1029�1034.
243. Müller N, Riedel M, Schwarz MJ, Engel RR: Efek klinis COX-2
penghambat kognisi pada skizofrenia. Eur Arch Psychiatry Clin Neurosci
2005, 255:149-151.
244. Müller N, Krause D, Dehning S, Musil R, Schennach-Wolff R, Obermeier M,
Moller HJ, Klauss V, Schwarz MJ, Riedel M: Pengobatan Celecoxib di awal
tahap skizofrenia: hasil acak, double-blind, placebocontrolled
percobaan pemberian amfibi celecoxib augmentasi.
Skizofr Res 2010, 121:118�124.
245. Sayyah M, Boostani H, Pakseresht S, Malayeri A: Sebuah acak awal
percobaan klinis double blind pada khasiat celecoxib sebagai tambahan di
pengobatan gangguan obsesif-kompulsif. Psikiatri Res 2011,
189: 403 406.
246. Sublette ME, Ellis SP, Geant AL, Mann JJ: Meta-analisis efek dari
eicosapentaenoic acid (EPA) dalam uji klinis pada depresi. J Clin
Psikiatri 2011, 72:1577�1584.
247. Bloch MH, Hannestad J: Asam lemak Omega-3 untuk perawatan
depresi: tinjauan sistematis dan meta analisis. Mol Psikiatri 2012,
17: 1272 1282.
248. Keller WR, Kum LM, Wehring HJ, Koola MM, Buchanan RW, Kelly DL: A
review agen anti-inflamasi untuk gejala skizofrenia.
J Psychopharmacol.
249. Warner-Schmidt JL, Vanover KE, Chen EY, JJ Marshall, Greengard P:
Efek antidepresan dari inhibitor reuptake serotonin selektif (SSRI)
dilemahkan oleh obat antiinflamasi pada tikus dan manusia. Proc Natl
Acad Sci AS 2011, 108:9262�9267.
250. Gallagher PJ, Castro V, Fava M, Weilburg JB, Murphy SN, Gainer VS, Churchill
SE, Kohane IS, Iosifescu DV, Smoller JW, Perlis RH: Respon antidepresan
pada pasien dengan depresi berat yang terpapar NSAID: a
studi farmakovigilans. Am J Psikiatri 2012, 169:1065�1072.
251. Shelton RC: Apakah penggunaan NSAID secara bersamaan mengurangi keefektifannya
antidepresan? Am J Psikiatri 2012, 169:1012�1015.
252. Martinez-Gras I, Perez-Nievas BG, Garcia-Bueno B, Madrigal JL, AndresEsteban
E, Rodriguez-Jimenez R, Hoenicka J, Palomo T, Rubio G, Leza JC:
Prograglandin anti-inflamasi 15d-PGJ2 dan reseptor nuklirnya
PPARgamma mengalami penurunan skizofrenia. Schizophr Res 2011,
128: 15 22.
253. Garcia-Bueno B, Perez-Nievas BG, Leza JC: Apakah ada peran untuk nuklir?
reseptor PPARgamma pada penyakit neuropsikiatrik? Int J
Neuropsikofarmakol 2010, 13:1411�1429.
254. Meyer U: Sinyal anti-inflamasi pada skizofrenia. Brain Behav
Imun 2011, 25:1507�1518.
255. Ramer R, Heinemann K, Merkord J, Rohde H, Salamon A, Linnebacher M,
Hinz B: COX-2 dan PPAR-gamma memberikan apoptosis yang disebabkan oleh cannabidiol.
sel kanker paru-paru manusia. Mol Cancer Ther 2013, 12:69�82.
256. Henry CJ, Huang Y, Wynne A, Hanke M, Himler J, Bailey MT, Sheridan JF,
Godbout JP: Minocycline menipiskan lipopolisakarida (LPS) -induced
neuroinflamasi, perilaku penyakit, dan anhedonia.
J Neuroinflamasi 2008, 5: 15.
257. Sarris J, Mischoulon D, Schweitzer I: Omega-3 untuk gangguan bipolar: metaanalyses
penggunaan mania dan depresi bipolar. J Clin Psychiatry 2012,
73: 81 86.
258. Amminger GP, Schafer MR, Papageorgiou K, Klier CM, Kapas SM, Harrigan
SM, Mackinnon A, McGorry PD, Berger GE: Asam lemak omega-3 rantai panjang
untuk pencegahan gangguan psikotik yang ditunjukkan: secara acak, placebocontrolled
uji coba. Arch Gen Psychiatry 2010, 67:146�154.
259. Fusar-Poli P, Berger G: Intervensi asam Eicosapentaenoic di
skizofrenia: meta-analisis penelitian acak terkontrol plasebo.
J Clin Psikofarmakol 2012, 32:179�185.
260. Zorumski CF, Paul SM, Izumi Y, Covey DF, Mennerick S: Neurosteroid,
stres dan depresi: Potensi kesempatan terapeutik.
Neurosci Biobehav Rev 2013, 37:109�122.
261. Uhde TW, Singeteddy R: Penelitian Biologis dalam Gangguan Kecemasan. Di
Psikiatri sebagai Neuroscience. Diedit oleh Juan Jose LI, Wolfgang G, Mario M,
Norman S. Chichester: John Wiley & Sons, Ltd; 2002:237�286.
262. Gibson SA, Korado Z, Shelton RC: Stres oksidatif dan glutathione
Respon dalam kultur jaringan dari orang-orang dengan depresi berat.
J Psychiatr Res 2012, 46:1326�1332.
263. Nery FG, Monkul ES, Hatch JP, Fonseca M, Zunta-Soares GB, Frey BN,
Bowden CL, Soares JC: Celecoxib sebagai tambahan dalam perawatan
episode depresif atau campuran gangguan bipolar: buta ganda,
studi acak, terkontrol plasebo. 2008, 23:87�94.
264. Levine J, Cholestoy A, Zimmerman J: Efek antidepresi yang mungkin terjadi pada
minocycline. 1996, 153: 582.
265. Levkovitz Y, Mendlovich S, Riwkes S, Braw Y, Levkovitch-Verbin H, Gal G,
Fennig S, Treves I, Kron S: Studi double blind dan acak dari
minocycline untuk pengobatan gejala negatif dan kognitif di Indonesia
skizohprenia fase awal. J Clin Psychiatry 2010, 71:138�149.
266. Miyaoka T, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
Kemungkinan efek antipsikotik minocycline pada pasien dengan
skizofrenia. Prog Neuropsychopharmacol Biol Psychiatry 2007, 31:304�307.
267. Miyaoka J, Yasukawa R, Yasuda H, Hayashida M, Inagaki T, Horiguchi J:
Minocycline sebagai terapi adjunctive untuk skizofrenia: sebuah label terbuka
belajar. 2008, 31:287�292.
268. Rodriguez CI, Bender J Jr, Marcus SM, Snape M, Rynn M, Simpson HB:
Minocycline augmentasi farmakoterapi secara obsesif-kompulsif
gangguan: uji coba label terbuka. 2010, 71:1247�1249.
doi:10.1186/1742-2094-10-43
Kutipan artikel ini sebagai: Najjar et al .: Neuroinflammation dan psikiatri
penyakit. Jurnal Neuroinflamasi 2013 10: 43.
Tutup Akordeon
Informasi di sini tentang "Peremajaan Neuroinflamasi Dan Psikiatri" tidak dimaksudkan untuk menggantikan hubungan pribadi dengan profesional perawatan kesehatan yang berkualifikasi atau dokter berlisensi dan bukan merupakan saran medis. Kami mendorong Anda untuk membuat keputusan perawatan kesehatan berdasarkan penelitian dan kemitraan Anda dengan profesional perawatan kesehatan yang berkualifikasi.
Informasi Blog & Ruang Lingkup Diskusi
Lingkup informasi kami terbatas pada Chiropractic, musculoskeletal, obat-obatan fisik, kesehatan, kontribusi etiologis gangguan viscerosoma dalam presentasi klinis, dinamika klinis refleks somatovisceral terkait, kompleks subluksasi, masalah kesehatan sensitif, dan/atau artikel, topik, dan diskusi kedokteran fungsional.
Kami menyediakan dan menyajikan kerjasama klinis dengan para ahli dari berbagai disiplin ilmu. Setiap spesialis diatur oleh ruang lingkup praktik profesional mereka dan yurisdiksi lisensi mereka. Kami menggunakan protokol kesehatan & kebugaran fungsional untuk merawat dan mendukung perawatan cedera atau gangguan pada sistem muskuloskeletal.
Video, postingan, topik, subjek, dan wawasan kami mencakup masalah, masalah, dan topik klinis yang terkait dengan dan secara langsung atau tidak langsung mendukung ruang lingkup praktik klinis kami.*
Kantor kami telah berusaha secara wajar untuk memberikan kutipan yang mendukung dan telah mengidentifikasi studi penelitian yang relevan atau studi yang mendukung postingan kami. Kami menyediakan salinan studi penelitian pendukung yang tersedia untuk dewan pengawas dan publik atas permintaan.
Kami memahami bahwa kami mencakup hal-hal yang memerlukan penjelasan tambahan tentang bagaimana hal itu dapat membantu dalam rencana perawatan atau protokol perawatan tertentu; oleh karena itu, untuk membahas lebih lanjut materi pelajaran di atas, jangan ragu untuk bertanya Dr Alex Jimenez, DC, atau hubungi kami di 915-850-0900.
Kami di sini untuk membantu Anda dan keluarga Anda.
Berkah
Dr. Alex Jimenez IKLAN, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
email: pelatih@elpasofungsionalmedicine.com
Lisensi sebagai Doctor of Chiropractic (DC) di Texas & New Mexico*
Lisensi Texas DC # TX5807, Lisensi New Mexico DC # NM-DC2182
Berlisensi sebagai Perawat Terdaftar (RN*) in Florida
Lisensi Florida Lisensi RN # RN9617241 (Kontrol No. 3558029)
Status Kompak: Lisensi Multi-Negara: Berwenang untuk Praktek di Status 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Kartu Bisnis Digital Saya